
二酸化炭素水に石灰水をまぜると白くにごるか。
これは実験すると,必ずしも「白くにごる」とは言えない。
白くにごるのは水に溶けない固体ができている。
もちろん,物は形によって分けることができる。
すなわち,固体・液体・気体である。
5年生で,固体が水に溶けるのには限度があり,溶ける程度が温度に関係することもあると,
勉強してきた。ところが,小麦粉のように水には溶けず,白くにごっている物もある。
固体のなかでも,水に溶ける様子でちがいがあるのだと分かった。
さて,気体では,それぞれにちがいがあるだろうか。
6年生では気体が水に溶けるようすにちがいがあるかどうかを調べる。
たとえば,空気は水に,ほとんど溶けない。
しかし,水に溶けている物もある。
塩酸,アンモニア水,二酸化炭素水がある。
これらについて調べる。
ここで,二酸化炭素が水に溶けるようすを調べる。
【問題】 水溶液には,気体がとけているものがあるのだろうか。
【実験2】 二酸化炭素は水にとけるかを調べましょう。
実験方法は水上置換を使う。
この利点は二酸化炭素が水に少しとけるが,気体として集めることができる点です。
【コメント】
ペットボトルに二酸化炭素を上方置換する。
このとき,勢いよく二酸化炭素を吹き込むと泡で入口が見えないため,
上手く集まらないことがあります。二酸化炭素の量が少な過ぎたり,
二酸化炭素が多過ぎて水が少ないと,
せんをしてふってもペットボトルがへこむことがありません。
おおよそ,半分ぐらいの水にしておくのがよいようです。
石灰水を入れるのを「少しずつ」と教科書に書かれています。これは重要なことです。
一度に多く加えると一旦白く濁った状態からすぐに色が消えます。
理由は白濁した状態でさらに炭酸水を加えると,
白いにごりである炭酸カルシウムが炭酸水素カルシウムとなって,
水にとけるからです。
各溶解度を示すと,下表のとおりです。
炭酸カルシウムの溶解度は, 25℃において 0.15g/100gの水
炭酸水素カルシウムの溶解度は,20℃において 16.6g/100gの水
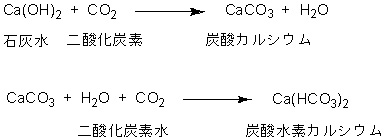
教科書に書かれている「少しずつ」は2つの意味があります。
1. 炭酸カルシウムの白濁が見られることと,
2. さらに炭酸水を加えるとその白濁が消えて無色透明になることです。
もちろん,後者の炭酸水素カルシウムの生成については書かれていません。
二つのことは,ともに重要なことです。
単に,「モノには適度というものがある」という教訓よりも,
ちがった反応が起こっていることです。
教科書の別のところでは,地球上の二酸化炭素の過剰は雨水の酸性化とともに,
石灰石で構成された建築物や記念物などの表面の溶けたり,汚れたりしたなどが示されています。
たしか,二酸化炭素水に石灰石(方解石など)は溶けないはずです。
なぜなら二酸化炭素を石灰水にふきこむと白くにごり,水に溶けない物ができます。
それは水にとけない炭酸カルシウムであり,石灰石の成分ですから。
ここで,二酸化炭素と石灰水,二酸化炭素水と石灰石の間に,矛盾があるように思えます。
つまり,片方は水に溶けない固体ができ,もう一方では固体の石が溶けるのです。
炭酸水素カルシウムが水に溶けやすいことが書かれておれば問題ありません。
そこまで,小学校で教えることはない,というなら,
二酸化炭素水の性質を矛盾なく説明する必要性がある,という問題が残ります。
私見では,二酸化炭素水の二様性をそれぞれの反応として教えるべきと思う。
もちろん,反応式や化合物として,表現する必要はない。
イメージとして次のようなとらえ方ができる。
