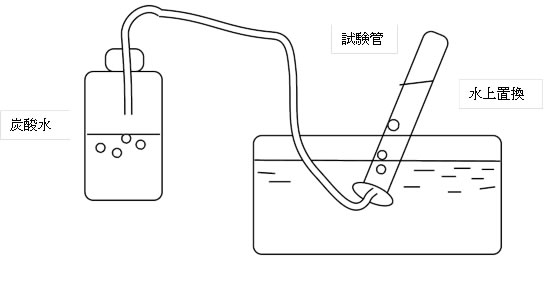
炭酸水のあわを集める実験
教科書東京書籍6年生理科のp172に,下記のような実験が示されています。
疑問:
- この実験をする必要があるのか。意味が分からない。
理解できない点: 炭酸水は水に二酸化炭素が溶けたものだから,
二酸化炭素を直接,試験管に水上置換すればよい。
- この実験装置で二酸化炭素を十分に集めることができるのか。
実験上の問題点: この水上置換では,出てきた二酸化炭素が
試験管内の水に溶けて集めるのが困難と考えられる。
これらの疑問に関して,理由を考えてみると,教科書記述の意図は単純な考えではなく,
進んだ考え方も含まれていそうです。また,説明やデータ・資料も必要になります。
- 疑問1について:
この疑問は「炭酸水は二酸化炭素を水に溶解させたものである」に基づいています。
これに対して,「炭酸水は炭酸を水に溶かしたものであるが,
二酸化炭素水は二酸化炭素を水に溶かしたものであって,
両者は異なる」という違いを指摘することもあります。
つまり相違性に対する知識・理論が必要と考えられます。
このような差異は,マイナーなことと受け取られるかもしれません。
しかし,化学的に厳密なことをいえば,
化合物である炭酸H2CO3と二酸化炭素水CO2+H2Oは別の物です。
従って,明確に区別されねばならないことです。ところが,両者の間には「化学平衡」があります。
もちろん,小学校では「化学平衡」は出てきません。しかし,「バランス」はあります。
具体的に,それは「てこ」の単元に出てきます。
自然界は外から力やエネルギーを加えないと,「バランス」がとれた状態で安定化します。
感覚的にこのことを子どもたちは気付いているようです。
化学のバランスを教える際に,ただ炭酸水と二酸化炭素水とは同じことと済ますことはできません。
教える方が,両者の違いを知識として知り,詳細を理解していることが大切と考えられます。

二酸化炭素水 炭酸水
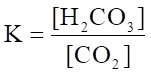
K=0.0035 (25℃) であるので,平衡はほとんど左に偏っている。
この平衡定数を見る限り,炭酸水といっても炭酸は僅かしか溶けていません。
しかし,炭酸を多くするには,二酸化炭素の圧力を上げればできることです。
正に,ル・シャトリエの法則です。この法則を知らなくても,
二酸化炭素を増やす(力点に加える力を大きくする)と,バランスをとるため,平衡は右に移動して,
炭酸が多くできることになちます。(作用点に加わる力も大きくなる)
売られている炭酸水はこのような二酸化炭素を加圧した状態になっています。
封を開けるとシューッと音がするのは加圧のためです。
それでは,一度炭酸水のキャップを開けると,ほとんど炭酸はなくなり二酸化炭素は空気中に出て行ってしまうのでしょうか。
そのようなことはありません。長い時間でなければ,二酸化炭素は水に溶けています。どうしてなのでしょうか。
その理由は溶解度に関係しています。そこで,
-
疑問2について:
次に,実験を行うためには,予め,物性値や定数(平衡定数など)を知っておく必要があります。
概念的には,二酸化炭素の水に対する溶解度は温度が下がると増加することを理解していると役立ちます。
溶解度は温度に関係すると,5年生の理科で学んでいます。
ミョウバンは温度を上げると水に溶けやすくなりました。
温度が上がると,ミョウバンの見えるつぶがお湯に広がって見えなくなるので溶けたことが分かりました。
あたかも,水が温まるとミョウバンの塊(かたまり)を削るように見えました。
言い換えれば,水の温度が高くなると,水が活発に動きやすくなり,ミョウバンの表面を溶かします。
この考え方を拡張すると,固体と液体との間には溶かす,溶かされるの関係があります,
そこで,キーポイントは「小さなつぶの運動の激しさ」と「混じり合い」です。
それでは,二酸化炭素と水の間ではどうでしょうか。今度は気体と液体との間の相互作用です。
「混じり合い」に関しては,振るなどすると簡単に混じり合います。
温度を上げると混じり合っている気体は空気中に出ていきやすいと考えられます。
つまり,二酸化炭素は温度を上げると水からはなれていくと予想できます。
すなわち,温度が上がると,水は二酸化炭素の小さなつぶを捕まえる力が弱くなり,
二酸化炭素の小さなつぶは水から離れていきます。その程度を理科年表(p536, 2018)からみると,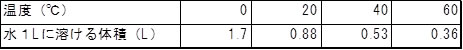
これをグラフにすると,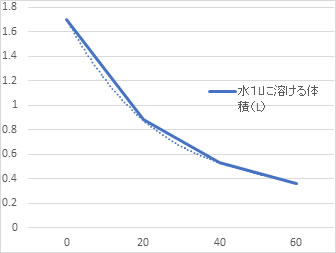
これらから,分かることは,二酸化炭素の水に対する溶解度は,温度が上がると小さくなることです。
ミョウバンと逆の関係になるのです。冷たい炭酸水は聞いたことがありますが,
温められた炭酸水というのは聞いたことがありませんね。
ここで,表にある水に溶けた二酸化炭素の体積を見てください。
温度が低いと二酸化炭素は水の体積と同じ程度に溶けます。水の体積に対して二酸化炭素の体積が大きいことです。
ところが,重さにすると,20℃では,溶けた二酸化炭素の重さは水に対して僅か1/1000ほどです。
気体と液体の間では,重さが同じ時にこれほど体積に差が出ます。
実験上の工夫: 炭酸水から二酸化炭素を発生する実験では,装置を組み上げてから,炭酸水を少し暖めるとよいでしょう。
二酸化炭素が出やすくなります。温めた後,ペットボトルを冷やすと,水上置換に使っている水が逆流します。
終わった後のゴム管を水から取り出しておくように注意しましょう。
展開実験:
柔らかいペットボトル(500mL程度)に水を半分ほど入れ,二酸化炭素のガスを吹きこんで,
ヒント:二酸化炭素は水に溶けます。同じ重さでも気体と液体では体積が大きく違います。
ペットボトルの中の空気と入れ替えます。このとき,二酸化炭素のガスを水の中には入れません。
ペットボトルのふたをします。これを振るとペットボトルはどうなるでしょうか。
ふくらむ,へこむ,変わらない
の3択で理由も答えましょう。(この実験は教科書に後ほど出てきますが,ここでは一連の考え方ができます)
---
2020.12.31 作成