海洋細菌による新しいがん免疫療法の開発に成功! ~遺伝子改変不要の天然細菌が大腸がんを選択的に攻撃~
海洋細菌による新しいがん免疫療法の開発に成功!
~遺伝子改変不要の天然細菌が大腸がんを選択的に攻撃~
【ポイント】
- 海洋細菌Photobacterium angustumが大腸がんに対して強力な抗腫瘍効果を示すことを世界で初めて発見
- 遺伝子改変を一切行わない天然細菌でありながら、がん組織に選択的に集積し、健康な臓器への影響が極めて少ない
- 細菌による直接的ながん細胞破壊と免疫系の活性化という二つのメカニズムで腫瘍を攻撃
- 従来の細菌療法と比較して優れた治療効果と安全性を確認
| 北陸先端科学技術大学院大学 物質化学フロンティア研究領域の都 英次郎教授と宮原 弥夏子大学院生(博士後期課程、JAIST SPRING研究員)らの研究チームは、海洋細菌*1Photobacterium angustum(フォトバクテリウム・アングスタム)が大腸がんに対して顕著な治療効果を示すことを発見しました。 本研究では、複数の海洋細菌株をスクリーニングした結果、P. angustumが遺伝子改変を施さない天然の状態で、がん組織に選択的に集積し、直接的な腫瘍溶解作用と強力な免疫活性化を引き起こすことを明らかにしました。マウスモデルにおいて、静脈内投与されたP. angustumは腫瘍組織に高度に集積する一方、肝臓を除く重要臓器への定着はほとんど認められず、血液学的異常や組織学的毒性も観察されませんでした。 さらに、P. angustumによる治療は、T細胞、B細胞、好中球などの免疫細胞の腫瘍内浸潤を促進し、腫瘍壊死因子α(TNF-α)やインターフェロンγ(IFN-γ)などの炎症性サイトカイン*2の産生を増強しました。また、細菌が産生する天然の外毒素*3により、がん細胞を直接破壊する能力も確認されました。これらの複合的な作用により、治療を受けたマウスの生存期間が著しく延長し、一部の個体では完全寛解が達成されました。 本研究成果は、遺伝子組み換え生物(GMO)*4に依存しない、より安全で生体適合性の高い新しいがん免疫療法の開発につながる重要な知見です。 この研究の詳細は、がん免疫療法分野の国際的トップジャーナルである「Journal for ImmunoTherapy of Cancer」に掲載されました。 |
【研究背景と内容】
がんは世界的な死因の上位を占めており、免疫チェックポイント阻害剤やCAR-T細胞療法などの画期的な免疫療法が開発されてきました。しかし、これらの治療法は高額であり、免疫関連の副作用、固形腫瘍における限定的な効果、腫瘍微小環境*5における免疫抑制機構などの課題があります。
細菌を用いたがん治療は150年以上前から検討されてきましたが、近年、特定の細菌種が腫瘍の低酸素環境や免疫抑制環境に選択的に定着し増殖する能力を持つことが明らかになり、注目を集めています。しかし、これまでの研究の多くは遺伝子改変された大腸菌やサルモネラ菌を用いており、安全性の懸念、複雑な製造プロセス、厳格な規制などの課題がありました。
本研究では、遺伝子改変を行わない天然の海洋細菌に着目し、がん治療への応用可能性を探索しました。
【研究の内容】
1. 海洋細菌のスクリーニング
研究グループは、P. angustum、P. phosphoreum、P. aquimaris、A. logei、P. indicumを含む複数の海洋細菌株について、大腸がんマウスモデルにおける抗腫瘍活性を評価しました。その結果、P. angustumのみが顕著な抗腫瘍効果を示し(図1)、生存期間を著しく延長させました。他の細菌株は高い毒性により投与後2日以内にマウスが死亡しました。
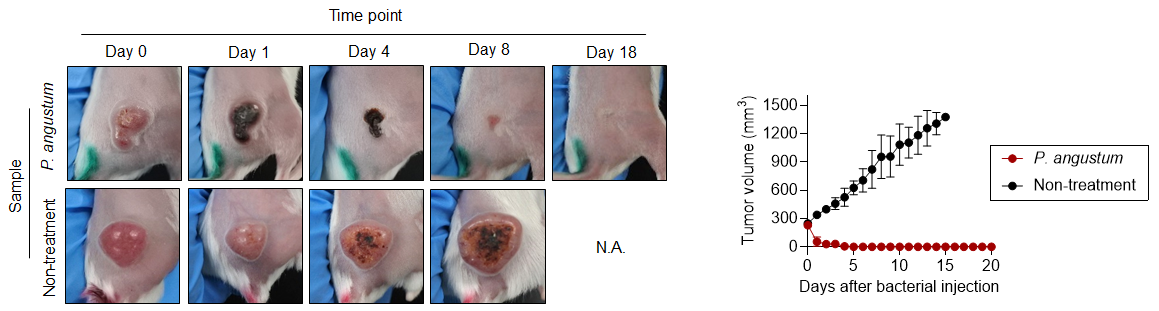
図1. 大腸がんマウスモデルにおけるP. angustumの抗腫瘍活性
2. 優れた安全性プロファイル
P. angustum投与後のマウスにおいて、体重減少や血液学的異常は認められませんでした。完全血球計算、生化学的分析、組織学的検査のいずれにおいても、毒性の徴候は観察されませんでした。また、炎症性サイトカインの上昇は毒性株と比較して顕著に低く、24時間後には肝臓を除く重要臓器から細菌が検出されませんでした。
3. 高い腫瘍選択性
静脈内投与されたP. angustumは、腫瘍組織に選択的に集積し、多数のコロニー形成が確認されました。一方、心臓、肺、腎臓、脾臓などの健康な臓器への定着はほとんど認められませんでした。
4. 二重の抗腫瘍メカニズム
P. angustumの抗腫瘍効果は、以下の二つのメカニズムによるものと考えられます(図2):
- 直接的な腫瘍溶解作用:細菌が産生する天然の外毒素(ヘモリシンなど)により、がん細胞を直接破壊
- 免疫系の活性化:T細胞、B細胞、好中球の腫瘍内浸潤を促進し、TNF-αやIFN-γなどの炎症性サイトカインの産生を増強
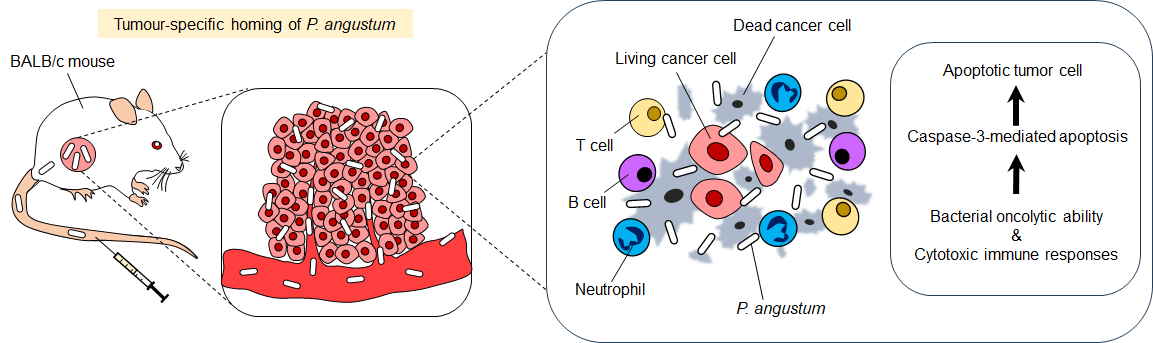
図2. P. angustumによる抗腫瘍メカニズム
5. 幅広い適用可能性
P. angustumは、炎症誘発性の大腸がんモデルに加え、薬剤耐性のトリプルネガティブ乳がんモデルにおいても顕著な抗腫瘍効果を示しました。これは、本治療法が大腸がん以外のがん種にも応用できる可能性を示唆しています。
【研究の意義と今後の展望】
本研究は、遺伝子改変を必要としない天然細菌が、安全かつ効果的ながん免疫療法として機能することを実証しました。今後は、さまざまながん種での有効性の検証、免疫チェックポイント阻害剤との併用効果の評価、長期的な免疫記憶の詳細な解析などを進める予定です。
また、P. angustumの腫瘍選択的な定着メカニズムや免疫活性化の分子機構をさらに解明することで、より効果的な治療法の開発につながることが期待されます。
本研究成果は、GMOに依存しない生体適合性の高い細菌療法という新しい治療パラダイムを提示するものであり、将来的には臨床応用に向けた開発が期待されます。
【研究支援】
本研究は、以下の研究資金の支援を受けて実施されました:
日本学術振興会(JSPS)科学研究費助成事業 基盤研究(A)(課題番号:23H00551)
同 科学研究費助成事業 挑戦的研究(開拓)(課題番号:22K18440)
同 地域中核・特色ある研究大学強化促進事業(課題番号:JPJS00420230006)
科学技術振興機構(JST)共創の場形成支援プログラム(課題番号:JPMJSF2318)
同 次世代研究者挑戦的研究プログラム(SPRING)(課題番号:JPMJSP2102)
【論文情報】
| 掲載誌 | Journal for ImmunoTherapy of Cancer |
| 論文題目 | Systemic administration of Photobacterium angustum promotes antitumor immunity and direct tumor lysis in murine models of colorectal cancer |
| 著者 | Mikako Miyahara, Teruhisa Takizawa, Matomo Sakari, Eijiro Miyako* |
| 掲載日 | 2025年11月19日にオンライン版に掲載 |
| DOI | 10.1136/jitc-2025-012665 |
【用語説明】
海洋環境に生息する細菌の総称。本研究で使用したPhotobacterium angustumは、特殊な培養条件を必要とせず、通常の海洋培地で培養可能。
細胞間の情報伝達に関与するタンパク質。TNF-αやIFN-γは免疫応答を促進する炎症性サイトカイン。
細菌が体外に分泌する毒性物質。本研究では、P. angustumが産生する外毒素ががん細胞を直接破壊することが示された。
遺伝子工学的手法により遺伝子を改変した生物。本研究で使用したP. angustumは天然株であり、遺伝子改変は行っていない。
がん組織とその周辺の細胞、血管、免疫細胞、シグナル分子などから構成される環境。多くの場合、低酸素状態や免疫抑制状態にある。
令和7年11月21日
