研究活動の検索
研究概要(研究室ガイド)やプレスリリース・受賞・イベント情報など、マテリアルサイエンスの研究室により公開された情報の中から、興味のある情報をタグや検索機能を使って探すことができます。タンパク質分子モーターで駆動する微小機械

タンパク質分子モーターで駆動する微小機械
バイオ分子機械工学 研究室
Laboratory on Bio-Molecular Mechanical Engineering
准教授:平塚 祐一(HIRATSUKA Yuichi)
E-mail:
[研究分野]
生命分子工学、機械工学、タンパク質工学、ナノバイオテクノロジー、生物物理学
[キーワード]
分子ロボティクス、MEMS/マイクロマシン、分子モーター、遺伝子工学
研究を始めるのに必要な知識・能力
平塚研究室ではタンパク質を使って人工の機械を作るという全く新しい研究分野を開拓しています。そのため分野を超えた幅広い知識が必要となりますが最も重要なことは「新しいものを作りたい!」という強い意識と「科学的な思考」です。専門的な知識は研究室で学ぶことができます。
この研究で身につく能力
本研究室では、バイオ・化学・微細加工技術・機械工学などを組み合わせた融合的な研究を進めています。融合研究を行うためには異なった専門分野を学んでいく必要があり、多くの学生は躊躇するかもしれません。しかし本研究室での研究開発の経験を通し融合領域では新しい発見や新しい可能性がたくさんあることを学び、専門分野間の垣根が低く感じることになるでしょう。もちろん基礎的な知識なくして融合分野に取り組むことはできません。本研究室では大きさ数ナノメータのタンパク質を人類が利用できるマイクロまたはミリメータサイズの機械として組み立てる研究をしています。そのためにタンパク質や化学物質の分子レベルの構造やナノメータ空間での挙動を理解し、分子レベルから設計できる能力を身につけます。
【就職先企業・職種】 化学メーカー、機械メーカー、IT企業、公務員など
研究内容

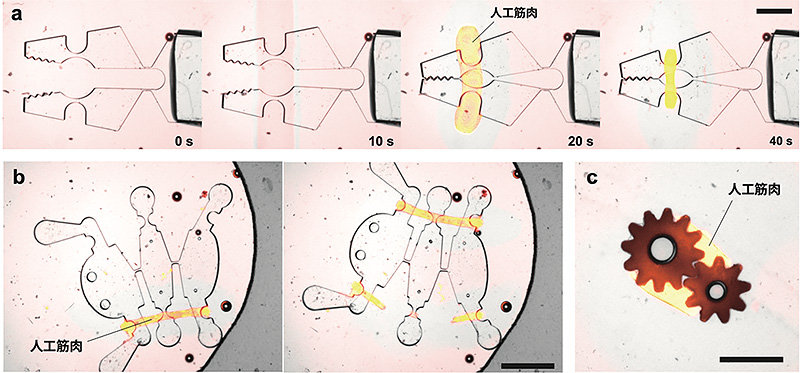
図1.光造形可能な人工筋肉で動く微小機械
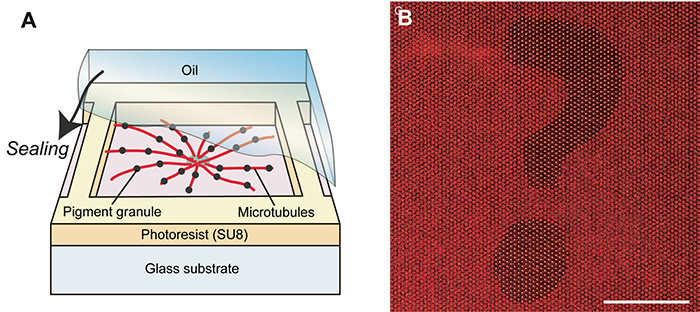
図2.モータータンパク質で駆動する世界初のディスプレイ
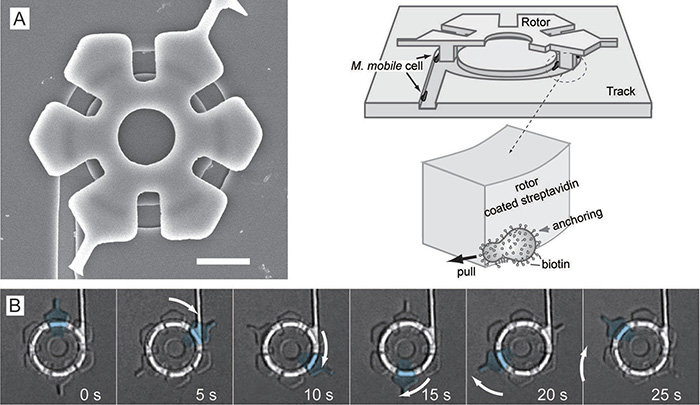
図3.バクテリアで駆動する回転モーター
細胞は、大きさ数ナノメートルのタンパク質がその内部で働くことでさまざまな生命現象を生み出しています。タンパク質は一般に知られているような単なる栄養素の一つではなく「非常に精巧な分子機械」であり「細胞を構成する多彩な部品」です。本研究室では、タンパク質を分子部品として使うことによって、これまで人類が作り出してきた人工機械とは全く異なる夢の微小機械(マイクロマシン、微小ロボット)の創製に挑んでいます。本研究室ではタンパク質の中でも特に「動く」という機能をもった面白いタンパク質「モータータンパク質」に注目し、モータータンパク質で駆動するさまざまな微小な機械の開発に取り組んでいます。
1)光で自在に作製可能な生体分子モーターで動く人工筋肉
筋肉のような収縮性のファイバー(人工筋肉)を、光照射した場所に自在に形成させることに成功しました。光の照射形状を変えることで自由な形状・大きさの人工筋肉が造形でき、ミリメートルスケールの微小機械の動力に利用できます。将来、マイクロロボットやソフトロボットの3Dプリンタによる製造への応用が期待されます。
2)タンパク質により駆動するバイオディスプレイ
生き物には周囲の環境に合わせて体色を変化させる「保護色機能」を持つものがいます。これらの現象はモータータンパク質によって引き起こされています。本研究では微細加工技術とタンパク質工学を組み合わせ、保護色の分子機構を模倣した人工細胞を生体外に作り、世界初のタンパク質で駆動するディスプレイの開発に成功しました。
3) モータータンパク質・バクテリアで動く回転モーター
大きさ数十μmの微小な回転モーターもモータータンパク質やバクテリアを使って作製することに成功しています。これらは従来の人工モーターとは異なり糖や ATP といった化学物質を燃料として動くユニークなモーターとして注目を集めています。
主な研究業績
- Takahiro Nitta, Yingzhe Wang, Zhao Du, Keisuke Morishima & Yuichi Hiratsuka A printable active network actuator built from an engineered biomolecular motor Nature Materials 20, 1149–1155 (2021)
- Susumu Aoyama, Masahiko Shimoike, and Yuichi Hiratsuka Self-organized optical device driven by motor proteins Proc. Nati. Acad. Sci. (PNAS) 110, 16408-16413 (2013).
- Y. Hiratsuaka, M. Miyata, T. Tada and T. Q.P. Uyeda, Micro-rotary motor powered by bacteria, Proc. Nati. Acad. Sci. (PNAS) 103, 13618-13623 (2006).
使用装置
レーザー直接描画装置フォトリソグラフィ装置
タンパク質精製および解析装置高感度
蛍光顕微鏡
細胞培養装置
研究室の指導方針
本研究室の学生には誰もが見たことがない・驚かれるような研究に挑戦してもらいたいと考えています。しかし、そのような研究を成功させるためには基礎的な知識はもちろんのこと論文による学習が必須となります。また自分自身で考え失敗にめげず何度も挑戦し、そして何よりも研究を楽しんでもらいたいと考えています。
[研究室HP] URL:https://www.jaist.ac.jp/ms/labs/hiratsuka/
マイクロロボットを"流れ"作業で迅速に作製 -生体分子モーターによる人工筋肉で自在にプリント・動的再構成可能に-

  |
国立大学法人 大阪大学 国立大学法人 北陸先端科学技術大学院大学 国立大学法人東海国立大学機構 岐阜大学 |
マイクロロボットを"流れ"作業で迅速に作製
-生体分子モーターによる人工筋肉で自在にプリント・動的再構成可能に-
【ポイント】
- マイクロ流路※1の中で、光に応答する材料を流しながら、マイクロロボット※2のボディと駆動源となるアクチュエータ※3を連続的に生産・組み立てを行う「マイクロロボットその場組み立て法」を開発
- 様々な機能をもつマイクロロボットの迅速な作製に成功
- より高機能なマイクロロボットの実現と、マイクロロボットの量産化に期待
【概要】
| 大阪大学・大学院工学研究科の森島圭祐教授、王穎哲特任研究員(常勤)は、 北陸先端科学技術大学院大学・先端科学技術研究科 バイオ機能医工学研究領域の平塚祐一准教授、岐阜大学・工学部の新田高洋教授との共同研究で、マイクロ流路内で、マイクロロボットの部品をプリント成形し、その場で組み立てることに成功しました。マイクロロボットの機械構造は光応答性ハイドロゲル※4でつくられ、アクチュエータは同じチームが開発した生体分子モーターからなる人工筋肉を利用しました。このアクチュエータと機械部品をマイクロ流路内で組み立てることにより、マイクロロボット製造の柔軟性と効率が向上しました。この方法で、様々な機能のマイクロロボットが実現されました。また、この成果により、これまで困難であった、特に柔軟な構造を持つマイクロソフトロボットの実現や、マイクロロボットの量産化が期待されます。 本研究成果は、2022年8月24日午後2時(米国時間)に発行される科学雑誌「Science Robotics」の表紙を飾りました。 |
【研究の背景】
マイクロロボット、特に柔軟な構造を持つロボットは、生物医学などの分野で非常に幅広い応用の可能性があるものの、小さなロボットにアクチュエータなど様々な機械部品を組み込むことは困難で、高機能のマイクロロボット開発の障害となっています。従来の方法では、通常、機械構造やアクチュエータなど、マイクロロボットの様々な部品を異なる場所で製造し、一つ一つ組み上げていくピック アンド プレース アセンブリによってマイクロロボットがつくられていました。この方法は時間と労力がかかり、また多くの制限があることが課題となっています。
【研究の内容】
本研究では、自然界の生体内システムの自己組織化プロセスに着想を得て、2021年に発表したプリント可能な生体分子モーターからなる人工筋肉(1)(2)に基づき、ロボット部品をその場で加工・組み立てしてマイクロロボットを製造する方法を開発しました。マイクロ流路内で、マスクレスリソグラフィー※5により、ハイドロゲル材料の機械的構造をプリントし、次に生体分子モーターからなる人工筋肉がハイドロゲル機構の狙った位置に直接プリントすることで、機構を駆動して目的の仕事を実施します(図1) 。 このその場組み立てにより、マイクロロボットを迅速に次々と生産することができます。
また、マイクロロボットに新しい人工筋肉を再プリントすることにより、アクチュエータを迅速に動的再構成し、複雑な仕事を行うマイクロロボットを実現しました(図2)。
さらに、生体分子モーターを使用する本研究とは異なる、生きた筋肉細胞を用いるアプローチとして細胞ハイブリッドロボット※6が注目されています。細胞ハイブリッドロボットは、柔軟性が高く、環境負荷が低いという利点があるものの、筋肉細胞の培養に数日かかってしまうという問題があります。本研究では、設計の柔軟性を向上させながら、製造プロセスを大幅に簡素化することに成功しました。今後のオンチッププリンティング技術の向上や人工筋肉の性能向上により、現在の細胞ハイブリッドロボットのボトルネックを打破し、実用化に向けた一歩を踏み出すことが期待される手法であると考えています。
(1) https://www.nature.com/articles/s41563-021-00969-6
(2) https://www.jaist.ac.jp/whatsnew/press/2021/04/20-1.html

図1 マイクロロボットその場組み立て法

図2 その場組み立て法によって製造したマイクロロボットが生体分子モーターからなる人工筋肉によって駆動する様子
【本研究成果が社会に与える影響(本研究成果の意義)】
今回の研究により、自然界の生体分子モーターによって運動が創発する自己組織化現象をオンチップ微小空間上で工学的に制御し、自在にデザインできる加工プロセスをボトムアップ的な発想でより簡便に実現できました。これにより、これまで超微小部品をトップダウン的に組み立てることが大きなボトルネックであったために遅れていた、マイクロロボットの組み立てやマイクロソフト機構のオンデマンド生産が可能になりました。今後、様々な機能を付与したマイクロロボットがオンチップ上で連続的にオンデマンド生産することが可能になり、化学エネルギーだけで駆動する超小型マイクロロボットが健康医療応用など様々な分野に展開、波及していくことが期待できます。
【特記事項】
本研究は、日本学術振興会(JSPS)科研費 基盤研究(S)(課題番号22H04951)、基盤研究(A)(課題番号22H00196)、基盤研究(B)(課題番号19H02106)、学術変革領域研究(A)(課題番号21H05880)、挑戦的萌芽研究(課題番号21K18700)、新エネルギー・産業技術総合開発機構(NEDO)「次世代人工知能・ロボット中核技術開発」(JPNP15009)の支援を受けて行われました。
【論文情報】
| タイトル | In situ integrated microrobots driven by artificial muscles built from biomolecular motors |
| 著者名 | Yingzhe Wang, Takahiro Nitta, Yuichi Hiratsuka ,and Keisuke Morishima |
| DOI | https://www.science.org/doi/10.1126/scirobotics.aba8212 |
【用語説明】
ガラスや高分子材料で作製した数ミリメートルから数マイクロメートルの流路で、効率的に化学反応などを起こすことができる。微小なバイオセンサーや化学分析装置に利用されている。
数ミリメートル以下のサイズのロボットで、医療などへの応用が期待されている。
モーターやエンジンなどのように電気や化学エネルギーなどを利用して、動きや力を発生する装置。
紫外線などの光を照射することでゼリー状に固まる物質。
光照射による微細加工技術で、半導体デバイスなどの製造に利用されている。
培養細胞と機械部品を融合させて作製したロボット。
【SDGs目標】

【参考URL】
森島圭祐教授 研究者総覧URL https://rd.iai.osaka-u.ac.jp/ja/90351526dc15ef59.html
生命機械融合ウェットロボティクス領域URL http://www-live.mech.eng.osaka-u.ac.jp/
令和4年8月26日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2022/08/26-1.html多機能ナノ粒子を用いて、無傷のリソソームを迅速かつ高純度に単離する手法を開発

  |
国立大学法人北陸先端科学技術大学院大学 国立大学法人東北大学 |
多機能ナノ粒子を用いて、無傷のリソソームを迅速かつ高純度に単離する手法を開発
ポイント
- 磁性―プラズモンハイブリッドナノ粒子を哺乳動物細胞のリソソーム内腔へエンドサイトーシス*1経路で高効率に送達することに成功
- ハイブリッドナノ粒子の細胞内輸送過程をプラズモンイメージング*2によって精確に追跡することで、高純度にリソソームを磁気分離するための最適培養時間を容易に決定可能
- リソソーム内腔にハイブリッドナノ粒子を送達後、細胞膜を温和に破砕し、4℃で30分以内にリソソームを磁気分離することで、細胞内の状態を維持したままリソソームの高純度単離に成功
| 北陸先端科学技術大学院大学(JAIST)(学長:寺野 稔、石川県能美市) 先端科学技術研究科 前之園 信也 教授、松村 和明 教授、平塚 祐一 准教授の研究チームは、東北大学(総長:大野 英男、宮城県仙台市)大学院生命科学研究科の田口 友彦教授と共同で、磁気分離能(超常磁性)とバイオイメージング能(プラズモン散乱*3特性)を兼ね備えた多機能ナノ粒子(磁性―プラズモンハイブリッドナノ粒子)を用いて、細胞内の状態を維持したままリソソームを迅速かつ高純度に単離する技術を世界で初めて開発しました。 |
【背景と経緯】
リソソームは60を超える加水分解酵素とさまざまな膜タンパク質を含む細胞小器官(オルガネラ)で、タンパク質、炭水化物、脂質、ヌクレオチドなどの高分子の分解と再利用に主要な役割を果たします。これらの機能に加えて、最近の発見では、リソソームがアミノ酸シグナル伝達にも関与していることがわかってきています。リソソーム機能障害に由来する疾患も数多く存在します。そのため、リソソームの機能をより深く理解することは基礎生物学においても医学においても重要な課題です。
リソソームの代謝物の探索は、近年急速に関心が高まっている研究分野です。たとえば、飢餓状態と栄養が豊富な状態でリソソームの代謝物を研究することにより、アミノ酸の流出がV-ATPaseおよびmTORに依存することが示されました(M. Abu-Remaileh et al., Science, 2017, 358, 807)。このように、外部刺激に応答したリソソームの動的な性質を調べるためには、リソソームを細胞内の状態を維持したまま迅速かつ高純度に分離する必要があります。
一般的に、リソソームの単離は密度勾配超遠心分離法*4によって行われていますが、密度勾配超遠心分離法には二つの大きな問題があります。まず一つ目の問題として、細胞破砕液にはほぼ同じ大きさと密度を持ったオルガネラが多種類あるため、得られた画分にはリソソーム以外の別のオルガネラが不純物として混ざっていることがよくあります。したがって、リソソーム画分のプロテオミクス解析を行っても、完全な状態のリソソームに関する情報を得ることができません。二つ目の問題として、分離プロセスに長い時間がかかるため、リソソームに存在する不安定なタンパク質は脱離、変性、または分解される可能性があります。この問題も、リソソームに関する情報を得ることを大きく妨げます。
これらの問題を克服するために、リソソームを迅速に単離するための他の技術が開発されました。たとえば、磁気ビーズを用いた免疫沈降法*5によってリソソームを迅速に分離できることが示されました(M. Abu-Remaileh et al., Science, 2017, 358, 807)。しかし、この手法では、ウイルスベクターのトランスフェクションなどによって抗体修飾磁気ビーズが結合できるリソソーム膜貫通タンパク質を発現させる必要があります。この方法は、密度勾配超遠心分離法よりも高純度のリソソーム画分が得られますが、リソソーム膜のタンパク質組成とその後のプロテオミクス解析に悪影響を与える可能性が指摘されています(J. Singh et al., J. Proteome Res., 2020, 19, 371-381.)。
【研究の内容】
本研究では、無傷のリソソームを迅速かつ効率的に分離する新たな単離法として、アミノデキストラン(aDxt)で表面修飾したAg/FeCo/Ag コア/シェル/シェル型磁性―プラズモンハイブリッドナノ粒子(MPNPs)をエンドサイトーシス経路を介してリソソームの内腔に集積した後、細胞膜を温和に破砕し、リソソームを磁気分離するという手法を開発しました(図1)。リソソームの高純度単離のためには、エンドサイトーシス経路におけるaDxt結合MPNPs(aDxt-MPNPs)の細胞内輸送を精確に追跡することが必要となります。そこで、aDxt-MPNPsとオルガネラの共局在の時間変化を、aDxt-MPNPsのプラズモンイメージングとオルガネラ(初期エンドソーム、後期エンドソームおよびリソソーム)の免疫染色によって追跡しました(図2)。初期エンドソームおよび後期エンドソームからのaDxt-MPNPsの脱離と、リソソーム内腔へのaDxt-MPNPsの十分な蓄積に必要な最適培養時間を決定し、その時間だけ培養後、リソソームを迅速かつマイルドに磁気分離しました。細胞破砕からリソソーム単離完了までの経過時間(tdelay)と温度(T)を変化させることにより、リソソームのタンパク質組成に対するtdelayとTの影響をアミノ酸分析によって調べました。その結果、リソソームの構造は細胞破砕後すぐに損なわれることがわかり、リソソームを可能な限り無傷で高純度で分離するには、tdelay ≤ 30分およびT = 4℃という条件で磁気分離する必要があることがわかりました(図3)。これらの条件を満たすことは密度勾配超遠心分離法では原理的に困難であり、エンドサイトーシスという細胞の営みを利用して人為的にリソソームを帯磁させて迅速かつ温和に単離する本手法の優位性が明らかとなりました。
本研究成果は、2022年1月3日(米国東部標準時間)に米国化学会の学術誌「ACS Nano」のオンライン版に掲載されました。
【今後の展開】
本手法はリソソーム以外のオルガネラの単離にも応用可能な汎用性のある技術であり、オルガネラの新たな高純度単離技術としての展開が期待されます。

図1 磁性―プラズモンハイブリッドナノ粒子を用いたリソソームの迅速・高純度単離法の概念図

| 図2 COS-1細胞におけるaDxt-MPNPsの細胞内輸送。 (A)aDxt-MPNPsの細胞内輸送の概略図(tは培養時間)。 (B)aDxt-MPNPsとリソソームマーカータンパク質(LAMP1)の共局在を示す共焦点レーザー走査顕微鏡像 (核:青、aDxt-MPNPs:緑、リソソーム:赤)。 aDxt-MPNPsはプラズモンイメージングによって可視化。 スケールバーは20 µm。 |

| 図3 単離されたリソソームのウエスタンブロッティングおよびアミノ酸組成分析の結果。 (A)ネガティブセレクション(NS)およびポジティブセレクション(PS)画分。 (B)PS画分の共焦点レーザー走査顕微鏡画像(緑:aDxt-MPNPs、赤:LAMP1)。 (C)NSおよびPS画分、および細胞破砕液のウエスタンブロット結果。 (D)異なる温度でtdelayを変化した際に得られたリソソーム画分のアミノ酸含有量の変化。 水色(4℃、tdelay = 30分)、青(4℃、tdelay = 120分)、ピンク(25℃、tdelay = 30分)、 および赤(25℃、tdelay = 120分)。 |
【論文情報】
| 掲載誌 | ACS Nano |
| 論文題目 | Quick and Mild Isolation of Intact Lysosomes Using Magnetic-Plasmonic Hybrid Nanoparticles (磁性―プラズモンハイブリッドナノ粒子を用いた完全な状態のリソソームの迅速かつ温和な単離) |
| 著者 | The Son Le, Mari Takahashi, Noriyoshi Isozumi, Akio Miyazato, Yuichi Hiratsuka, Kazuaki Matsumura, Tomohiko Taguchi, Shinya Maenosono* |
| 掲載日 | 2022年1月3日(米国東部標準時間)にオンライン版に掲載 |
| DOI | 10.1021/acsnano.1c08474 |
【用語説明】
*1.エンドサイトーシス:
細胞が細胞外の物質を取り込む過程の一つ
*2.プラズモンイメージング:
プラズモン散乱を用いて、光の回折限界以下のサイズの金属ナノ粒子を光学顕微鏡(蛍光顕微鏡や共焦点顕微鏡など)で可視化すること
*3.プラズモン散乱:
金属ナノ粒子表面での自由電子の集合振動である局在表面プラズモンと可視光との相互作用により、可視光が強く散乱される現象
*4.密度勾配超遠心分離法:
密度勾配のある媒体中でサンプルに遠心力を与えることで、サンプル中の構成成分がその密度に応じて分離される方法
*5.免疫沈降法:
特定の抗原を認識する抗体を表面修飾したビーズ用い、標的抗原が発現したオルガネラを細胞破砕液中から選択的に分離する免疫化学的手法
令和4年1月5日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2022/01/05-2.html生体分子モーターで動く人工筋肉、光で自在に作製可能 ― マイクロ・ソフトロボットの3Dプリントの実現に期待 ―

 |
| 国立大学法人 北陸先端科学技術大学院大学 国立大学法人東海国立大学機構 岐阜大学 国立大学法人 大阪大学 |
生体分子モーターで動く人工筋肉、光で自在に作製可能
― マイクロ・ソフトロボットの3Dプリントの実現に期待 ―
ポイント
- 光照射した場所に自在な形状に作製できる人工筋肉の開発に成功
- 遺伝子工学的に改変した生体分子モーターからなる光応答性の分子システムを開発
- ミリメートルスケールの微小機械の駆動を実証
- マイクロロボットやソフトロボットの3Dプリントの実現に期待
| 北陸先端科学技術大学院大学・先端科学技術研究科 生命機能工学領域の平塚祐一准教授、杜釗 大学院生(博士前期課程)は、岐阜大学・工学部の新田高洋准教授、大阪大学・大学院工学研究科 機械工学専攻の森島圭祐教授、王穎哲 大学院生(博士後期課程/特任研究員)との共同研究で、筋肉のような収縮性のファイバー(以下、人工筋肉)を、光照射した場所に自在に形成させることに成功した。この人工筋肉は、生物の動きに関わるタンパク質である生体分子モーターを遺伝子工学的に改変することにより実現した。光の照射形状を変えることで自由な形状・大きさの人工筋肉が造形でき、ミリメートルスケールの微小機械の動力に利用できることを実証した。この成果は将来、これまで困難であったマイクロロボットやソフトロボットの3Dプリンタによる製造への応用が期待される。 本研究成果は、2021年4月19日(英国時間)に科学雑誌「Nature Materials」誌のオンライン版で公開された。なお、本研究は新エネルギー・産業技術総合開発機構(NEDO)「次世代人工知能・ロボット中核技術開発」(JPNP15009)、日本学術振興会(JSPS)科研費 新学術領域研究「分子ロボティクス」の支援を受けて行われた。 |
【研究背景と内容】
生物のエンジン「筋肉」は、モータータンパク質[*1]と呼ばれる生体分子モーターから構築されており、数百マイクロメートル(マイクロは100万分の1)から数十メートルまでスケーラビリティにとんだアクチュエータである。生物のエネルギー源(アデノシン三リン酸 (ATP))を用いて高い効率で力学的仕事を行うという、従来のアクチュエータと比べ質的に異なる特性を持ち、これまでには無い産業分野での応用が期待されている。しかし、筋肉自体または筋肉細胞をアクチュエータとして利用する試みは基礎研究レベルでは報告されているが、筋肉細胞の安定性・保存性の問題やアクチュエータとして組み込む技術が未発達のため、実用化には至っていない。また、筋肉組織の構成分子はほぼ同定されているが、それら構成分子から筋肉を再構築する技術は知られていなかった。
本研究では、生体内の収縮性ファイバーの形成過程に着想を得て、人工筋肉を自在に形成させる分子システムを開発した。モータータンパク質の一種であるキネシンを遺伝子工学的に改変し、フィラメント状にすることにより、レールタンパク質である微小管[*2]と混ぜるだけで、モータータンパク質の動的な機能により自己組織的に人工筋肉を形成させることができた。さらに、光照射によりモーター分子のフィラメント化を開始させ、照射した部位のみに人工筋肉を形成させることを可能とした(図1)。この人工筋肉を大きさ数ミリメートルの機械構造内に形成させることにより微小機械を駆動させることに成功した(図2)。
筋肉のような柔軟で低エネルギー・低環境負荷なアクチュエータの産業応用は期待されているが、上述のように実用化には至っていない。本研究では、生体の運動素子であるモータータンパク質分子を数ミリメートル以上の組織に構築することにより、生物の筋肉に似た機能・性質を持つ人工筋肉の製造を可能とした。特に光照射により人工筋肉の形成を開始可能なことから、たとえば光造形型の3Dプリンタに組み込めば人工筋肉の光造形などが可能になることが将来期待でき、生体材料で駆動するマイクロロボットやソフトロボットの3Dプリント技術の基盤技術となる可能性が高い。
【今後の展開】
本研究で開発された人工筋肉は、現時点では形成・収縮が同時に起こり、かつ収縮は一回のみで用途も限定される。今後、制御用の分子システムを開発することにより、可逆または振動可能な人工筋肉を開発しマイクロロボットやソフトロボットへの実装を目指す。

図1.光照射による人工筋肉形成のコンセプト図
モータータンパク質の一種キネシンを遺伝子工学的に改変し、光照射によりキネシンがフィラメント状になるように設計(K456m13とCaMLMM)。キネシンフィラメントは自身の運動能により微小管を引っ張り、自己組織的に筋肉に似た収縮性の繊維を形成する。

図2. 人工筋肉の応用例
大きさ数ミリメートルのシリコンゴム製の微小構造の周囲に、光照射により人工筋肉を形成させ、その構造を駆動させた。右上)マイクログリッパ:光照射後に人工筋肉(オレンジ色)が形成し、20秒後にグリッパが閉じる。右下)昆虫型デバイス:人工筋肉により左右に動く。左上)ロボットアーム型デバイス。左中)微小歯車の組み立て。左下)細胞サイズの微小ビーズの集積。
【研究資金】
・新エネルギー・産業技術総合開発機構(NEDO)「次世代人工知能・ロボット中核技術開発」(JPNP15009)
・日本学術振興会(JSPS)科研費 新学術領域研究「分子ロボティクス」(JP24104004)
・日本学術振興会(JSPS)科研費 基盤研究(B)(JP18H01407)
【論文情報】
| 雑誌名 | Nature Materials |
| 題名 | "A printable active network actuator built from an engineered biomolecular motor" |
| 著者名 | Takahiro Nitta, Yingzhe Wang, Zhao Du, Keisuke Morishima and Yuichi Hiratsuka* |
| 掲載日 | 2021年4月19日(英国時間)にオンライン版に掲載 |
| DOI | 10.1038/s41563-021-00969-6 |
【用語解説】
[*1] モータータンパク質(motor protein)
生体の動きに関与するタンパク質の総称。大きさ数ナノメートル〜数十ナノメートルの分子で、代表的なものとして筋収縮に働くミオシン、細胞内の物質輸送に働くキネシン、鞭毛運動等に働くダイニンなどが挙げられる。これらは繊維状のタンパク質であるアクチンまたは微小管の上を生体のエネルギーであるATP(アデノシン三リン酸)の加水分解エネルギーを利用して一方向に動く。
[*2] 微小管(microtubule)
細胞骨格を構成する繊維状タンパク質のひとつ。大きさ数ナノメートルのチューブリンが筒状に重合することにより直径25ナノメートルの管状の繊維を形成する。キネシンやダイニンなどモータータンパク質が動くレールとして働く。
令和3年4月20日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2021/04/20-1.html蛍光タンパク質フォトルミネッセンスの電気制御に成功
蛍光タンパク質フォトルミネッセンスの電気制御に成功
ポイント
- 蛍光タンパク質とは下村脩らが発見したGFP及びその類縁分子の総称で、大きさおよそ4ナノメートル、基礎医学・生物学研究に広く利用されている。今回、金属と水溶液の界面に蛍光タンパク質を配置し、そのフォトルミネッセンス(蛍光)を電気制御することに世界で初めて成功した。
- この原理をもとに、蛍光タンパク質を用いた微小ディスプレイの作成と動作にも成功した。
|
北陸先端科学技術大学院大学(JAIST)(学長・浅野哲夫、石川県能美市)の先端科学技術研究科のTRISHA, Farha Diba(博士後期課程学生)、濱宏丞(博士前期課程学生・研究当時)、生命機能工学領域の今康身依子研究員、平塚祐一准教授、筒井秀和准教授らの研究グループは、蛍光タンパク質のフォトルミネッセンス(蛍光)を電気的に制御する手法を世界で初めて確立し、この原理を用いた微小ディスプレイの作成と動作に成功した。
蛍光タンパク質とは、下村脩らによりオワンクラゲから最初に発見された緑色蛍光タンパク質(GFP)及びその類縁分子の総称で、大きさおよそ4ナノメートル、成熟の過程で自身の3つのアミノ酸が化学変化を起こし明るい蛍光発色団へと変化する。生体内の細胞や分子を追跡したり、局所環境センサーを作ったりすることが可能になり、GFPの発見は2008年のノーベル化学賞の対象になった。蛍光タンパク質は多様な光学特性を示すことでも知られ、例えば、フォトスイッチングという現象を使うと、蛍光顕微鏡の空間解像度を格段に良くすることができ、その技術も2014年のノーベル化学賞の対象に選ばれた。 研究グループは、金薄膜に蛍光タンパク質を固定化し、±1~1.5V程度の電圧を溶液・金属膜間に印加することによりフォトルミネッセンスが最大1000倍以上のコントラスト比で変調される現象を発見した。またこの原理に基づいた、大きさ約0.5ミリのセグメントディスプレイの試作と動作に成功した(下図)。 本成果は、5月8日(水)に「Applied Physics Express (アプライド・フィジックス・エクスプレス)」誌に掲載された。 なお、本研究は、国立研究開発法人理化学研究所・光量子工学研究センターとの共同研究であり、また、科学研究費補助金、光科学技術振興財団、中部電気利用基礎研究支援財団などの支援を受けて行われた。 |

<今後の展開>
基礎医学・生物学研究で広く使われている蛍光タンパク質の性質は、溶液や細胞内環境において詳しく調べられてきた。今回、金属―溶液の界面という環境において、新たな一面を示すことが明らかになった。現状での表示装置としての性能は既存技術に比べれば動作速度や安定性の点で及ばないものの、今後、電気制御メカニズムの詳細が明らかになれば、蛍光タンパク質の利用は、分子センサー素子など、従来の分野を超えてより多様な広がりをみせる可能性がある。
<論文情報>
"Electric-field control of fluorescence protein emissions at the metal-solution interface"
(金属・溶液界面における蛍光タンパク質発光の電圧制御)
https://iopscience.iop.org/article/10.7567/1882-0786/ab1ff6
T. D. Farha, K. Hama, M. Imayasu, Y. Hiratsuka, A. Miyawaki and H. Tsutsui
Applied Physics Express (2019)
令和元年5月16日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2019/05/16-1.html「BIO tech 2017 内 第14回アカデミックフォーラム」に出展
6月28日(水)~30日(金)の3日間、東京ビッグサイト(東京都江東区有明)にてバイオ・ライフサイエンスに係る大規模展示会「BIO tech 2017(第16回バイオ・ライフサイエンス研究展)」が開催され、同展示会内で催された「第14回アカデミックフォーラム」に、本学から生命機能工学領域の藤本健造教授及び平塚祐一准教授が出展しました。
藤本教授はUFC(超高速光架橋)法を用いた核酸類操作について、平塚准教授はモータータンパク質で駆動するマイクロロボットの開発について、ポスター発表を行いました。2日目には藤本教授、平塚准教授ともに口頭発表も行い、訪れた聴講者で本学ブースは賑わいを見せていました。
ポスター発表は3日間通しで行われ、本学ブースには企業や大学、公的研究機関から約200名の方々が訪れました。本学展示説明者は、展示した研究成果について資料を用いながら説明し、来訪者と活発な情報交換を行っていました。

藤本教授

平塚准教授


本学出展ブースにて来訪者へ説明・情報交換等を行う様子
平成29年7月7日
https://www.jaist.ac.jp/whatsnew/info/2017/07/07-1.htmlBIO tech 2017 内 第14回アカデミックフォーラムに本学が出展
6月28日(水)~30日(金)の3日間、東京ビッグサイト(東京都江東区有明)でBio Tech 2017(第16回 バイオ・ライフサイエンス研究展)が開催されます。同展示会内で催される、大学・国公立研究所の研究者がバイオ研究の成果発表を行う「第14回アカデミックフォーラム」に、本学から以下の2研究室が出展します。
ご来場の際にはぜひお立ち寄りください。
| 日 時 | 平成29年6月28日(水) ~6月30日(金) 28日(水) 10:00~18:00 29日(木) 10:00~18:00 30日(金) 10:00~17:00 |
| 会 場 | 東京ビッグサイト 西3・4ホール(東京都江東区有明3-11-1) |
| 出展研究室 |
■生命機能工学領域 藤本 健造 教授 「UFC(超高速光架橋)法を用いた核酸類操作」 【ポスター展示ブース】 B-32 【口頭発表】 日時:6月29日(木) 12:30~13:00 会場:ACA-2 【展示概要】 http://d.bio-t.jp/ja/Expo/2725308/---- |
| ■生命機能工学領域 平塚 祐一 准教授 「モータータンパク質で駆動するマイクロロボットの開発」 【ポスター展示ブース】 B-31 【口頭発表】 日時:6月29日(木) 10:30~11:00 会場:ACA-1 【展示概要】 http://d.bio-t.jp/ja/Expo/2725309/---- |
詳細はこちらをご覧ください。
・Bio Tech2017 公式サイト http://www.bio-t.jp/
・アカデミックフォーラム ページ http://www.bio-t.jp/Academia/About/
生命機能工学領域の平塚准教授らの共同研究がNEDO「次世代人工知能・ロボット中核技術開発」に採択
生命機能工学領域の平塚祐一准教授が参画する研究課題が、国立研究開発法人新エネルギー・産業技術総合開発機構(NEDO)の「次世代人工知能・ロボット中核技術開発」に採択されました。
NEDOは、2015年に策定された政府の「ロボット新戦略」を受け、2015年度から「次世代人工知能・ロボット中核技術開発」を推進しています。このプロジェクトは、現在のロボット関連技術の延長上に留まらない、人間の能力を超えることを狙った革新的な要素技術をターゲットとし、これまで人工知能・ロボットの導入を考えもつかなかった未開拓の分野で、新しい需要を創出することを狙っています。
NEDOは、次世代の人工知能・ロボットの研究開発強化に向けて、「次世代人工知能技術分野」および「革新的ロボット要素技術分野」において、今まで実現されていない革新的な要素技術をターゲットに公募を実施し、今回、13テーマを採択しました。
■採択期間
平成28年度~平成29年度(継続の可能性あり)
■研究課題
「生体分子を用いたロボットの研究開発」
■共同研究機関
国立大学法人北陸先端科学技術大学院大学
国立大学法人東京工業大学
国立大学法人北海道大学
詳しくはNEDOホームページをご覧下さい。
http://www.nedo.go.jp/news/press/AA5_100599.html
平成28年7月19日
出典:JAIST お知らせ https://www.jaist.ac.jp/whatsnew/info/2016/07/19-1.html
