研究活動の検索
研究概要(研究室ガイド)やプレスリリース・受賞・イベント情報など、マテリアルサイエンスの研究室により公開された情報の中から、興味のある情報をタグや検索機能を使って探すことができます。材料とバイオを使ってゲームチェンジングテクノロジーを生み出す!


材料とバイオを使ってゲームチェンジング
テクノロジーを生み出す!
先進生物工学研究室 Laboratory on Advanced Bioengineering
教授:都 英次郎(MIYAKO Eijiro)
E-mail:
[研究分野]
生物工学、材料化学、ナノテクノロジー、ナノメディシン
[キーワード]
ナノロボット、ナノバイオ、ナノ材料、生体機能材料、バイオテクノロジー、バイオミメティクス
研究を始めるのに必要な知識・能力
研究を始めるにあたり特別な知識・能力は問いません。本物の科学者や世界で活躍できる第一線の研究者に本気でなりたいと考えている学生を募集しています。特に新しい技術や新分野を開拓しようと柔軟性、協調性、好奇心、志を持った熱心な学生を求めています。
この研究で身につく能力
私たちの研究室では色々な研究手法を組み合わせた学際的な研究を行っているので多くのことを学ぶことができます。例えば、有機合成、生化学、遺伝子工学、細胞や動物実験に係る手技、ナノ材料、医療用デバイス、ロボットなどの様々な知識や技術を習得することができます。
研究内容

図1. 革新的ナノバイオシステム創出を目指したナノロボットの一例(生体内で光と磁場で駆動するナノトランスポーター)。

図2. 全自動人工花粉交配を目指したミツバチ型ロボット(プロトタイプ)。効率的に花粉を運ぶために粘着性ゲルを塗布した動物体毛を極小ドローンの下部に取り付けている。
私たちの研究室の興味は、生物工学、材料化学、ナノテクノロジー、ナノメディシンの領域にあります。
例えば、我々の研究室では、ナノ材料の様々な物理化学的特性を活用することで、ナノスケールレベルで体の中の生物学的な活性や健康状態をモニターし、制御可能な革新的ナノバイオシステムの開発に挑戦しています(図1)。また、本研究目的のために高性能ナノロボットの合成、それらの表面工学、集合体を研究し、作製したナノロボットを上記の研究領域に統合することに注力しています。さらに、合成したナノロボットの構造と機能の関係における根本的な理解にも努めています。これらの研究はナノテクノロジー等の基礎研究としても重要ですが、とりわけ医学・薬学の分野において有用な知見と病気の治療法を提供できると期待しています。
一方、我々は食品産業や農業分野のためにも社会を一変させる革新的な技術(ゲームチェンジングテクノロジー)を創出しようと奮闘しています。現在、農作物の生産量に直結するミツバチなどの花粉媒介昆虫の減少が世界規模の問題となっています。昆虫を使った花粉交配法の代替手段として古来より羽毛や筆を用いた人の手による人工的な受粉が行われていますが、この方法は手間と労力が掛かる上、実際に作業を行う農家の方々の高齢化と人手不足が深刻な状況になっています。そこで我々の研究室では、全自動の人工花粉交配技術を構築すべく、自然から着想を得て設計するネイチャーインスパイアード材料とロボット工学を融合した研究を行っています(図2)。
このように我々の研究は、化学、物理、生物、材料科学、工学といった多くの研究分野から成る学際的な性質によって成り立っています。
過去の代表的な研究テーマ
- 体の中で光発電するナノデバイス
- 液体金属ナノトランスフォーマー
- 超分子ナノ電車
- 細胞を刺激するナノモジュレーター
- ナノ材料の光発熱を利用した遺伝子発現制御
- 光と磁場で駆動するナノトランスポーター
- 材料工学を駆使した花粉交配用ミツバチロボット
これらは単なる一例にすぎません。自然科学を理解・開拓し、革新的な新技術、ひいては新分野そのものを一緒につくりましょう!
主な研究業績
- Yue Yu, Xi Yang, Sheethal Reghu, Sunil C. Kaul, Renu Wadhwa, Eijiro Miyako*, "Photothermogenetic inhibition of cancer stemness by near-infrared-light-activatable nanocomplexes" Nature Communications 11, 4117 (2020).
- Svetlana A. Chechetka, Yue Yu, Xu Zhen, Manojit Pramanik, Kanyi Pu, Eijiro Miyako*, “Light-driven liquid metal nanotransformers for biomedical theranostics” Nature Communications 8, 15432 (2017).
- Eijiro Miyako*, Kenji Kono, Eiji Yuba, Chie Hosokawa, Hidenori Nagai, Yoshihisa Hagihara “Carbon nanotube-liposome supramolecular nanotrains for intelligent molecular-transport systems” Nature Communications 3, 1226 (2012).
使用装置
レーザー、蛍光顕微鏡、電子顕微鏡、紫外-可視-近赤外分光光度計、蛍光光度計など
研究室の指導方針
ディスカッション、雑誌会、定期ミーティング、学会などを通じて、実験の解析技術、独立した思考能力、論理的な表現力などが身に付くように指導します。特に、博士後期課程への進学希望者には、最新かつ国際的な研究環境を提供し、産業やアカデミアの研究ポジションが得られるように育成します。研究室のコアタイムは基本的には1時間の休憩を除いた9時から17時です。このため効率的、効果的、スピーディに作業をしなければいけません。メリハリをもって研究も余暇もエンジョイしましょう。
[研究室HP] URL:https://miyakoeijiro.wixsite.com/eijiro-miyako-lab
物質化学フロンティア研究領域の都教授らのAUN技術に係る論文がNature Biomedical Engineering誌 2025年 傑出論文に選定
物質化学フロンティア研究領域の都 英次郎教授らの研究グループによる、複合細菌AUNを用いたがん治療技術に関する論文が、Nature Biomedical Engineering誌において「2025年の傑出した論文(Outstanding Paper)」として選定されました。
本研究は、腫瘍内から単離された2種の天然細菌からなる複合細菌AUNが、免疫応答に依存せず腫瘍を選択的に破壊することを明らかにしたものであり、既存の免疫療法や遺伝子改変細菌とは異なる、新たながん治療の可能性を示しています。
本成果は、がん治療における新規モダリティ創出に貢献するものとして高く評価されました。
本研究は基礎研究に留まらず、現在、スタートアップ創業と臨床応用を見据えた事業化フェーズへと進んでおり、研究成果の社会実装を本格的に加速しています。
詳細:https://www.nature.com/articles/s41551-025-01595-2
■論文情報
令和7年12月25日
出典:JAIST お知らせ https://www.jaist.ac.jp/whatsnew/info/2025/12/25-1.html国際的な総合科学雑誌Natureのオンライン版に都教授らのAUN技術に係る記事広告が掲載
国際的な総合科学雑誌 Natureのオンライン版に、物質化学フロンティア研究領域の都 英次郎教授と研究チームが進める「AUN細菌コンソーシアムによるがん治療技術」の研究に関する記事広告「Could cancer-attacking bacteria offer a new way to treat tumours?」が掲載されました。
掲載記事(Nature Partner Content)
https://www.nature.com/articles/d42473-025-00331-3
令和7年12月23日
出典:JAIST お知らせ https://www.jaist.ac.jp/whatsnew/info/2025/12/23-2.html両生類・爬虫類の腸内細菌から画期的ながん治療細菌を発見!

両生類・爬虫類の腸内細菌から画期的ながん治療細菌を発見!
【ポイント】
- 両生類・爬虫類の腸内から採取した天然細菌が、一度限りの投与でがん組織を完全に消失させることを実証
- 細菌による直接的ながん細胞殺傷と、免疫系の活性化による間接的攻撃の両方を実現
- 既存の化学療法や免疫療法を上回る治療効果を示しながら、正常組織への悪影響なし
- 多様な固形がんへの適用が期待され、新たながん治療法開発への道を拓く
| 北陸先端科学技術大学院大学 物質化学フロンティア研究領域の都 英次郎教授の研究チームは、ニホンアマガエル(Dryophytes japonicus)、アカハライモリ(Cynops pyrrhogaster)、カナヘビ(Takydromus tachydromoides)の腸内から計45株の細菌を単離しました。これらの細菌を系統的にスクリーニングした結果、9株が抗腫瘍効果を示し、中でもニホンアマガエルの腸内から単離した細菌Ewingella americanaが、マウスのがんモデルで一度限りの投与により腫瘍を完全に消失させる極めて強力な抗がん作用を持つことを発見しました。 近年、腸内細菌とがんの関係が注目されていますが、これまでは主に腸内細菌叢全体の調整や糞便移植などの間接的アプローチが中心でした。本研究では、これとは全く異なるアプローチとして、腸内細菌を単離・培養し、直接静脈投与することで、がんを直接攻撃する革新的な治療法を開発しました。 本研究成果は、国際学術誌Gut Microbesに掲載されました。 |
【研究の詳細】
・驚異的な治療効果
マウスを用いた大腸がんモデルにおいて、E. americanaをたった一回静脈投与するだけで、腫瘍が完全に消失し、100%の完全奏効[注1]率(CR率)を達成しました(図1)。これは、現在標準治療として使われている免疫チェックポイント阻害薬[注2](抗PD-L1抗体)やリポソーム化ドキソルビシン(化学療法剤)を大きく上回る治療効果です。
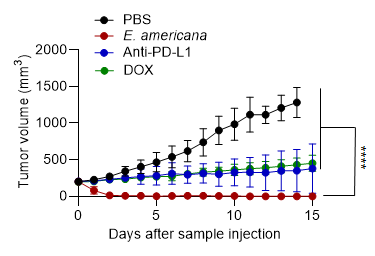
図1. 抗がん効果:Ewingella americanaと従来治療法との比較
| 腫瘍応答:E. americana単回静脈内投与(200 µL、5 × 10⁹ CFU/mL)、ドキソルビシン(DOX)または抗PD-L1抗体4回投与(200 µL、2.5 mg/kg/回)、PBSを対照として使用。データ:平均値 ± 標準誤差(n = 5)。****、p < 0.0001(スチューデントの両側 t 検定) |
・二重作用による抗がん効果
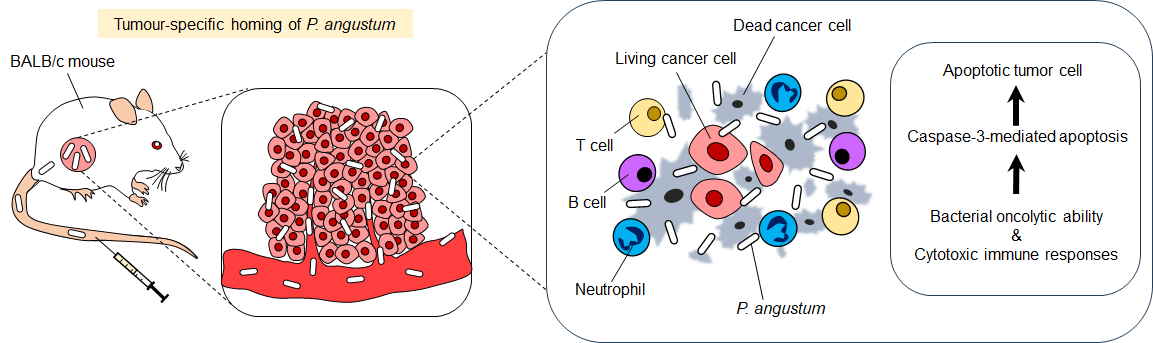
E. americanaは以下の二つのメカニズムでがんを攻撃します(図2)。
- 直接的殺傷効果:
通性嫌気性細菌[注3] であるE. americanaは、低酸素状態のがん組織に選択的に集積し、がん細胞を直接破壊します。腫瘍内での細菌数は投与後24時間で約3,000倍に増加し、効率的にがん組織を攻撃します。 - 免疫活性化効果:
細菌の存在が免疫系を強力に刺激し、T細胞、B細胞、好中球などの免疫細胞ががん組織に集結します。これらの免疫細胞が産生する炎症性サイトカイン(TNF-α、IFN-γ)がさらに免疫応答を増幅し、がん細胞のアポトーシス(細胞死)を誘導します。

図2. Ewingella americanaの抗腫瘍メカニズム
・腫瘍特異的な集積メカニズム
E. americanaは、がん組織に選択的に集積し、正常組織には全く定着しません。この驚くべき腫瘍特異性は、以下の複合的メカニズムによるものと考えられます。
- 低酸素環境:がん組織特有の低酸素状態が嫌気性細菌の増殖を促進
- 免疫抑制環境:がん細胞が発現するCD47[注4]タンパク質により局所的免疫抑制が生じ、細菌が生存しやすい環境を形成
- 異常血管構造:がん組織の血管は穴が多く、細菌が容易に侵入できる
- 代謝異常:がん特有の代謝産物が細菌の選択的増殖を支援
・優れた安全性プロファイル
詳細な安全性評価により、E. americanaは以下の特徴を示しました。
- 血中から急速に除去(半減期約1.2時間、24時間後には完全に検出不能)
- 肝臓、脾臓、肺、腎臓、心臓などの正常臓器に細菌の定着は一切なし
- 一過性の軽度炎症反応のみで、72時間以内に正常化
- 60日間の長期観察でも慢性毒性なし
【今後の展開】
本研究により、天然細菌を用いた新しいがん治療法の可能性が実証されました。今後は以下の研究開発を進める予定です。
- 他のがん種への適用拡大:乳がん、膵臓がん、メラノーマなど、多様ながん種での効果検証
- 投与方法の最適化:分割投与、腫瘍内投与など、より安全で効果的な投与法の開発
- 併用療法の開発:既存の免疫療法や化学療法との組み合わせによる相乗効果の検証
本研究は、未開拓の生物多様性が新たな医療技術開発の宝庫であることを示すとともに、難治性がん患者に新たな治療選択肢を提供する可能性を秘めています。
【用語解説】
治療により腫瘍が完全に消失し、検査で確認できなくなった状態。
がん細胞による免疫抑制を解除し、T細胞ががん細胞を攻撃できるようにする薬剤。
酸素がある環境でも無い環境でも増殖できる細菌。がん組織の低酸素領域で選択的に増殖できる。
細胞表面に発現する「食べないで」信号を出すタンパク質。がん細胞はこれを過剰発現して免疫細胞による攻撃を回避する。
【論文情報】
| 掲載誌 | Gut Microbes |
| タイトル | Discovery and characterization of antitumor gut microbiota from amphibians and reptiles: Ewingella americana as a novel therapeutic agent with dual cytotoxic and immunomodulatory properties |
| 著者 | Seigo Iwata, Nagi Yamasita, Kensuke Asukabe, Matomo Sakari, Eijiro Miyako* |
| 掲載日 | 2025年12月10日 |
| DOI | 10.1080/19490976.2025.2599562 |
【研究資金】
本研究は、以下の研究資金の支援を受けて実施されました。
日本学術振興会(JSPS)科学研究費助成事業 基盤研究(A)(課題番号:23H00551)
同 科学研究費助成事業 挑戦的研究(開拓)(課題番号:22K18440)
同 地域中核・特色ある研究大学強化促進事業(課題番号:JPJS00420230006)
科学技術振興機構(JST)共創の場形成支援プログラム(課題番号:JPMJSF2318)
同 次世代研究者挑戦的研究プログラム(SPRING)(課題番号:JPMJSP2102)
令和7年12月15日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2025/12/15-1.html物質化学フロンティア研究領域の都教授がSmall Science編集諮問委員に就任
物質化学フロンティア研究領域の都 英次郎教授がドイツWiley社の国際学術誌"Small Science"のEditorial Advisory Board(編集諮問委員)に就任しました。
Small Scienceは、ナノ・マイクロスケール科学の分野における最先端研究を扱う国際的なオープンアクセスジャーナルであり、同分野を代表する"Small"系列誌の一つとして高い評価を得ています。Editorial Advisory Boardは、誌の将来的な方向性や新たな研究領域の提案、学術コミュニティとの連携強化など、戦略的な側面から雑誌の発展に助言を行う役割を担っています。
都教授は、米国Cell Press社Cell Reports Physical ScienceおよびiScienceにおいてもEditorial Advisory Boardを務めており、国際的な学術出版の場で活躍の幅を広げています。
今後、同教授はSmall Scienceの発展に寄与するとともに、学術界における国際的な研究交流の推進に取り組んでいく予定です。
詳細:https://onlinelibrary.wiley.com/page/journal/26884046/homepage/editorial-board
令和7年11月26日
出典:JAIST お知らせ https://www.jaist.ac.jp/whatsnew/info/2025/11/26-1.html海洋細菌による新しいがん免疫療法の開発に成功! ~遺伝子改変不要の天然細菌が大腸がんを選択的に攻撃~
海洋細菌による新しいがん免疫療法の開発に成功!
~遺伝子改変不要の天然細菌が大腸がんを選択的に攻撃~
【ポイント】
- 海洋細菌Photobacterium angustumが大腸がんに対して強力な抗腫瘍効果を示すことを世界で初めて発見
- 遺伝子改変を一切行わない天然細菌でありながら、がん組織に選択的に集積し、健康な臓器への影響が極めて少ない
- 細菌による直接的ながん細胞破壊と免疫系の活性化という二つのメカニズムで腫瘍を攻撃
- 従来の細菌療法と比較して優れた治療効果と安全性を確認
| 北陸先端科学技術大学院大学 物質化学フロンティア研究領域の都 英次郎教授と宮原 弥夏子大学院生(博士後期課程、JAIST SPRING研究員)らの研究チームは、海洋細菌*1Photobacterium angustum(フォトバクテリウム・アングスタム)が大腸がんに対して顕著な治療効果を示すことを発見しました。 本研究では、複数の海洋細菌株をスクリーニングした結果、P. angustumが遺伝子改変を施さない天然の状態で、がん組織に選択的に集積し、直接的な腫瘍溶解作用と強力な免疫活性化を引き起こすことを明らかにしました。マウスモデルにおいて、静脈内投与されたP. angustumは腫瘍組織に高度に集積する一方、肝臓を除く重要臓器への定着はほとんど認められず、血液学的異常や組織学的毒性も観察されませんでした。 さらに、P. angustumによる治療は、T細胞、B細胞、好中球などの免疫細胞の腫瘍内浸潤を促進し、腫瘍壊死因子α(TNF-α)やインターフェロンγ(IFN-γ)などの炎症性サイトカイン*2の産生を増強しました。また、細菌が産生する天然の外毒素*3により、がん細胞を直接破壊する能力も確認されました。これらの複合的な作用により、治療を受けたマウスの生存期間が著しく延長し、一部の個体では完全寛解が達成されました。 本研究成果は、遺伝子組み換え生物(GMO)*4に依存しない、より安全で生体適合性の高い新しいがん免疫療法の開発につながる重要な知見です。 この研究の詳細は、がん免疫療法分野の国際的トップジャーナルである「Journal for ImmunoTherapy of Cancer」に掲載されました。 |
【研究背景と内容】
がんは世界的な死因の上位を占めており、免疫チェックポイント阻害剤やCAR-T細胞療法などの画期的な免疫療法が開発されてきました。しかし、これらの治療法は高額であり、免疫関連の副作用、固形腫瘍における限定的な効果、腫瘍微小環境*5における免疫抑制機構などの課題があります。
細菌を用いたがん治療は150年以上前から検討されてきましたが、近年、特定の細菌種が腫瘍の低酸素環境や免疫抑制環境に選択的に定着し増殖する能力を持つことが明らかになり、注目を集めています。しかし、これまでの研究の多くは遺伝子改変された大腸菌やサルモネラ菌を用いており、安全性の懸念、複雑な製造プロセス、厳格な規制などの課題がありました。
本研究では、遺伝子改変を行わない天然の海洋細菌に着目し、がん治療への応用可能性を探索しました。
【研究の内容】
1. 海洋細菌のスクリーニング
研究グループは、P. angustum、P. phosphoreum、P. aquimaris、A. logei、P. indicumを含む複数の海洋細菌株について、大腸がんマウスモデルにおける抗腫瘍活性を評価しました。その結果、P. angustumのみが顕著な抗腫瘍効果を示し(図1)、生存期間を著しく延長させました。他の細菌株は高い毒性により投与後2日以内にマウスが死亡しました。
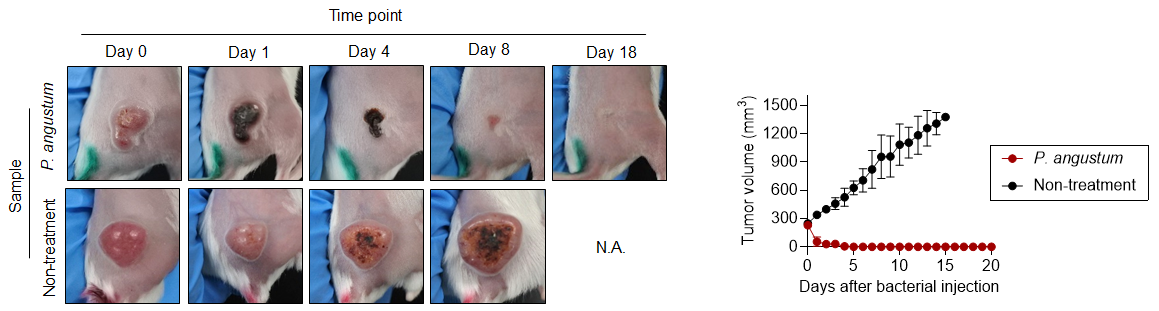
図1. 大腸がんマウスモデルにおけるP. angustumの抗腫瘍活性
2. 優れた安全性プロファイル
P. angustum投与後のマウスにおいて、体重減少や血液学的異常は認められませんでした。完全血球計算、生化学的分析、組織学的検査のいずれにおいても、毒性の徴候は観察されませんでした。また、炎症性サイトカインの上昇は毒性株と比較して顕著に低く、24時間後には肝臓を除く重要臓器から細菌が検出されませんでした。
3. 高い腫瘍選択性
静脈内投与されたP. angustumは、腫瘍組織に選択的に集積し、多数のコロニー形成が確認されました。一方、心臓、肺、腎臓、脾臓などの健康な臓器への定着はほとんど認められませんでした。
4. 二重の抗腫瘍メカニズム
P. angustumの抗腫瘍効果は、以下の二つのメカニズムによるものと考えられます(図2):
- 直接的な腫瘍溶解作用:細菌が産生する天然の外毒素(ヘモリシンなど)により、がん細胞を直接破壊
- 免疫系の活性化:T細胞、B細胞、好中球の腫瘍内浸潤を促進し、TNF-αやIFN-γなどの炎症性サイトカインの産生を増強

図2. P. angustumによる抗腫瘍メカニズム
5. 幅広い適用可能性
P. angustumは、炎症誘発性の大腸がんモデルに加え、薬剤耐性のトリプルネガティブ乳がんモデルにおいても顕著な抗腫瘍効果を示しました。これは、本治療法が大腸がん以外のがん種にも応用できる可能性を示唆しています。
【研究の意義と今後の展望】
本研究は、遺伝子改変を必要としない天然細菌が、安全かつ効果的ながん免疫療法として機能することを実証しました。今後は、さまざまながん種での有効性の検証、免疫チェックポイント阻害剤との併用効果の評価、長期的な免疫記憶の詳細な解析などを進める予定です。
また、P. angustumの腫瘍選択的な定着メカニズムや免疫活性化の分子機構をさらに解明することで、より効果的な治療法の開発につながることが期待されます。
本研究成果は、GMOに依存しない生体適合性の高い細菌療法という新しい治療パラダイムを提示するものであり、将来的には臨床応用に向けた開発が期待されます。
【研究支援】
本研究は、以下の研究資金の支援を受けて実施されました:
日本学術振興会(JSPS)科学研究費助成事業 基盤研究(A)(課題番号:23H00551)
同 科学研究費助成事業 挑戦的研究(開拓)(課題番号:22K18440)
同 地域中核・特色ある研究大学強化促進事業(課題番号:JPJS00420230006)
科学技術振興機構(JST)共創の場形成支援プログラム(課題番号:JPMJSF2318)
同 次世代研究者挑戦的研究プログラム(SPRING)(課題番号:JPMJSP2102)
【論文情報】
| 掲載誌 | Journal for ImmunoTherapy of Cancer |
| 論文題目 | Systemic administration of Photobacterium angustum promotes antitumor immunity and direct tumor lysis in murine models of colorectal cancer |
| 著者 | Mikako Miyahara, Teruhisa Takizawa, Matomo Sakari, Eijiro Miyako* |
| 掲載日 | 2025年11月19日にオンライン版に掲載 |
| DOI | 10.1136/jitc-2025-012665 |
【用語説明】
海洋環境に生息する細菌の総称。本研究で使用したPhotobacterium angustumは、特殊な培養条件を必要とせず、通常の海洋培地で培養可能。
細胞間の情報伝達に関与するタンパク質。TNF-αやIFN-γは免疫応答を促進する炎症性サイトカイン。
細菌が体外に分泌する毒性物質。本研究では、P. angustumが産生する外毒素ががん細胞を直接破壊することが示された。
遺伝子工学的手法により遺伝子を改変した生物。本研究で使用したP. angustumは天然株であり、遺伝子改変は行っていない。
がん組織とその周辺の細胞、血管、免疫細胞、シグナル分子などから構成される環境。多くの場合、低酸素状態や免疫抑制状態にある。
令和7年11月21日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2025/11/21-1.html令和7年度 第3回 超越バイオメディカルDX研究拠点 ネオ・エクセレントコアセミナー

下記のとおりセミナーを開催しますので、ご案内します。
| 日時 | 令和7年12月19日(金) 15:00~16:10 |
| 場所 | JAISTイノベーションプラザ 2F シェアードオープンイノベーションルーム |
| 講演者 | 宮崎大学工学教育研究部化学生命プログラム担当 大島 達也 教授 |
| 講演題目 | 大学教育研究×AI・データサイエンス×情報発信:溶かす技術開発を通じて |
| 使用言語 | 日本語 |
| 参加申込 | ・参加費無料 ・要予約(定員30名) 下記の担当へ前日までにメールにてお申し込みください。 【本件担当・予約申込先】 北陸先端科学技術大学院大学 超越バイオメディカルDX研究拠点 教授 都 英次郎 (e-miyako |
物質化学フロンティア研究領域の都教授がBioJapan 2025 NINEJP「ピッチ&マッチングカンファレンス」研究シーズ部門において最優秀賞を受賞

物質化学フロンティア研究領域の都英次郎教授が、北陸地域の大学等発スタートアップ支援拠点Tech Startup HOKURIKU(TeSH)の代表としてBioJapan 2025 NINEJP「ピッチ&マッチングカンファレンス」に登壇し、研究シーズ部門において最優秀賞(Best Academic Seed Award)を受賞しました。
BioJapan 2025 NINEJP「ピッチ&マッチングカンファレンス」は、令和7年10月10日にパシフィコ横浜で開催された、NINEJPが主催する公式ピッチセッションです。全国9つのプラットフォームから推薦されたバイオ分野の革新的な研究者と有望な大学発スタートアップが研究成果と事業化構想を発表し、技術的独創性と将来性を競い合いました。
NINEJPは、JSTの「大学発新産業創出基金事業(全国ネットワーク構築支援)」の一環として設立された、全国9つの大学等発スタートアップ・プラットフォームが連携するイノベーション・エコシステムです。日本全体でグローバルに通用するディープテック事業を創出することを目的としています。
※参考:BioJapan 2025
NINEJP
Tech Startup HOKURIKU(TeSH)
■受賞年月日
令和7年10月10日
■発表テーマ
高い安全性と強力な抗腫瘍効果を併せ持つ腫瘍内細菌コンソーシアムを用いた次世代型がん細菌療法
(Nature's Own Bacterial Consortium: A Gene-Free,Safe,and Powerful Cancer Therapy)
■発表者
都英次郎
■受賞対象となった研究の内容
「Nature's Own Bacterial Consortium: A Gene-Free, Safe, and Powerful Cancer Therapy」 と題した発表を行い、遺伝子改変を必要としない天然細菌コンソーシアム AUN による革新的ながん細菌療法について紹介しました。
本技術は、高い安全性と免疫非依存的な抗腫瘍効果を両立させる全く新しい治療モダリティとして、審査委員より、その科学的独創性と臨床応用の可能性が高く評価され、最優秀賞の受賞に至りました。
■受賞にあたって一言
この受賞は、北陸地域発の研究シーズが全国レベルで高く評価された成果であり、TeSHおよび本学が推進するアカデミア創薬・ディープテック領域の強みを示すものです。
JAISTおよびTeSHでは、今後も地域発の優れたシーズを発掘・育成し、グローバルに展開可能なスタートアップ創出を目指して取り組んでまいります。


令和7年11月11日
出典:JAIST 受賞https://www.jaist.ac.jp/whatsnew/award/2025/11/11-1.html物質化学フロンティア研究領域の都教授がCell Reports Physical Science編集諮問委員会に就任
物質化学フロンティア研究領域の都 英次郎教授が米国Cell Press社が刊行する国際学術誌 Cell Reports Physical Scienceの編集諮問委員会(Editorial Board of Advisors, EAB)委員に就任しました。
Cell Reports Physical Scienceは、物理科学分野と生命科学分野の学際的研究を対象とした国際的ジャーナルであり、特にナノ材料の生物医学応用やライフサイエンスとの融合領域における注目度の高い成果を発表しています。EABは、今後の研究分野の方向性や新進気鋭の研究者の推薦など、学術誌の戦略的運営に助言を行う役割を担っています。
都教授は、ナノバイオテクノロジーやドラッグデリバリーシステム、さらには「リビングドラッグ」と呼ばれる微生物を活用する次世代治療法の開発など、幅広い先端研究を推進しています。すでにCell Press社の国際誌 iScience においても編集諮問委員を務めており、今回の就任はその国際的評価と研究の学際性が改めて認められたものです。
今後も国際的な研究交流と学術誌運営への積極的な貢献を通じて、世界の科学と医療の発展に寄与することが期待されます。
詳細:https://www.cell.com/cell-reports-physical-science/advisory-board
令和7年10月29日
出典:JAIST お知らせ https://www.jaist.ac.jp/whatsnew/info/2025/10/29-3.html「BioJapan 2025」に出展

10月8日(水)から10日(金)までの3日間、パシフィコ横浜(神奈川県横浜市)にて「BioJapan 2025」が開催されました。会期中の来場者数は22,167名(前回比141%)にのぼり、会場は多くの熱気と交流にあふれました。
本学からは、超越バイオメディカルDX研究拠点(eMEDX)がブースを出展し、都 英次郎教授によるプレゼンテーション「複合細菌AUNを用いた固形がん治療法」を行いました。会期中は、eMEDX会員をはじめ、ライフサイエンス関連の製造業や教育・学習支援業など、幅広い分野の方々にブースや出展者プレゼンテーションへお立ち寄りいただき、活発な意見交換が行われました。ご来場いただいた皆さまに、心より御礼申し上げます。
今後もeMEDXでは、健康・医療・ライフサイエンス分野における最先端の研究や取り組みを紹介しながら、未来志向の共創を通じて、産学官連携の新たな可能性を発信してまいります。
【超越バイオメディカルDX研究拠点】
https://www.jaist.ac.jp/ricenter/emedx/




令和7年10月24日
出典:JAIST お知らせ https://www.jaist.ac.jp/whatsnew/info/2025/10/24-1.html物質化学フロンティア研究領域の都教授らの研究チームが「S2S Japan 2025」において、ファイナリストに選出
物質化学フロンティア研究領域の都 英次郎教授らの研究チームが、アカデミア発ディープテック・スタートアップ支援プログラム 「S2S Japan 2025(Science to Startup Japan)」 において、ファイナリスト(最終選考進出者) に選出されました。
本プログラムは、革新的な大学発シーズをグローバル投資家・産業界へ橋渡しすることを目的としており、世界的に有望な技術・研究成果が選抜されます。
都教授らの研究チームは、「Nature's Own Bacterial Duo: A Gene-Free, Safe, and Powerful Cancer Therapy (AUN)」と題した遺伝子改変を用いない天然細菌コンソーシアムAUN(阿吽)による新規がん治療技術の研究開発に取り組んでいます。
AUNは、免疫非依存的かつ高い安全性を有する新しい細菌がん治療法として注目を集めており、その科学的独創性と社会的インパクトが高く評価されました。
都教授は、2025年11月13日(木)開催の「S2S Japan Symposium」 にて、同技術の研究成果と事業化ビジョンについて発表を行う予定です。
【参考情報】
・S2S Japan公式サイト: https://s2s-japan.com/
・プログラム主催: S2S Japan運営事務局
・会場: 東京ミッドタウン八重洲カンファレンス(予定)
令和7年10月16日
出典:JAIST お知らせ https://www.jaist.ac.jp/whatsnew/info/2025/10/16-1.html10月8日(水)~10日(金) BioJapan 2025に出展
10月8日(水)から10日(金)までの3日間、パシフィコ横浜(神奈川県横浜市)にて、世界で最も歴史あるバイオテクノロジー展「BioJapan 2025」が開催されます。
本学からは超越バイオメディカルDX研究拠点がブース出展し、都 英次郎教授が出展者プレゼンテーションに登壇します。ご来場の際には事前登録のうえ、ぜひ本学ブースへお立ち寄りください。
(来場案内)https://jcd-expo.jp/jp/
※事前登録:無料(当日の来場登録:5,000円)
| 日 時 | 10月8日(水)~10月10日(金) 各日 10時00分~17時00分 |
| 会 場 | パシフィコ横浜(神奈川県横浜市西区みなとみらい1-1-1) |
| ブース出展 | 【ブース名】国立大学法人北陸先端科学技術大学院大学 超越バイオメディカルDX研究拠点 【小間番号】A-9 |
| プレゼンテーション | 【日 時】10月10日(金)15時35分~16時05分 【場 所】Presentation Stage D 【テーマ】『複合細菌AUNを用いた固形がん治療法』 【講演者】都 英次郎 |
詳細はこちらをご覧ください。
・BioJapan 2025 公式サイト
がん光免疫療法のための多機能性液体金属ナノ複合体の開発に成功! ~乳酸菌と液体金属の革新的融合により、がんの可視化・診断・治療の一体化を実現~
がん光免疫療法のための多機能性液体金属ナノ複合体の開発に成功!
~乳酸菌と液体金属の革新的融合により、がんの可視化・診断・治療の一体化を実現~
【ポイント】
- 乳酸菌成分と液体金属からなる革新的ナノ複合体の作製に世界で初めて成功
- マウス移植がんの可視化と治療効果を実証
- 免疫賦活化(活性化)と光熱変換の相乗効果により、近赤外光照射でがんを完全消失
- 優れた生体適合性を確認、新たながん診断・治療技術創出への期待
| 北陸先端科学技術大学院大学 物質化学フロンティア研究領域の都 英次郎教授らの研究チームは、液体金属*1表面に乳酸菌*2成分と近赤外蛍光色素(インドシアニングリーン*3)を被覆した多機能性ナノ複合体の開発に成功しました。 開発したナノ複合体は、EPR効果*4により、がん細胞を標的とする能力に優れており、大腸がんを移植したマウスの腫瘍内に効果的に集積することを確認しました。さらに、生体透過性の高い近赤外レーザー光*5照射により、以下の治療効果を実現しました。
実際に、近赤外光を2日に1回5分間、計2回照射することで、マウスの移植がんを5日後に完全消失させることに成功しました。また、包括的な生体適合性試験により、本ナノ複合体の高い安全性も確認されています。
本研究成果は、診断と治療を統合した革新的ながん光免疫治療技術の創出につながる可能性が期待されます。 |
【研究背景と内容】
液体金属ナノ粒子への着目
ガリウム・インジウム(Ga/In)合金からなる室温液体金属は、優れた生体適合性と物理化学的特性を有し、バイオメディカル応用において世界的に注目されています。都教授らは、「免疫賦活化物質を液体金属と組み合わせ、がん患部に選択的送達できれば、強力な抗腫瘍効果と近赤外光を用いた診断・治療の統合が実現できる」との着想から研究を開始しました(図1)。
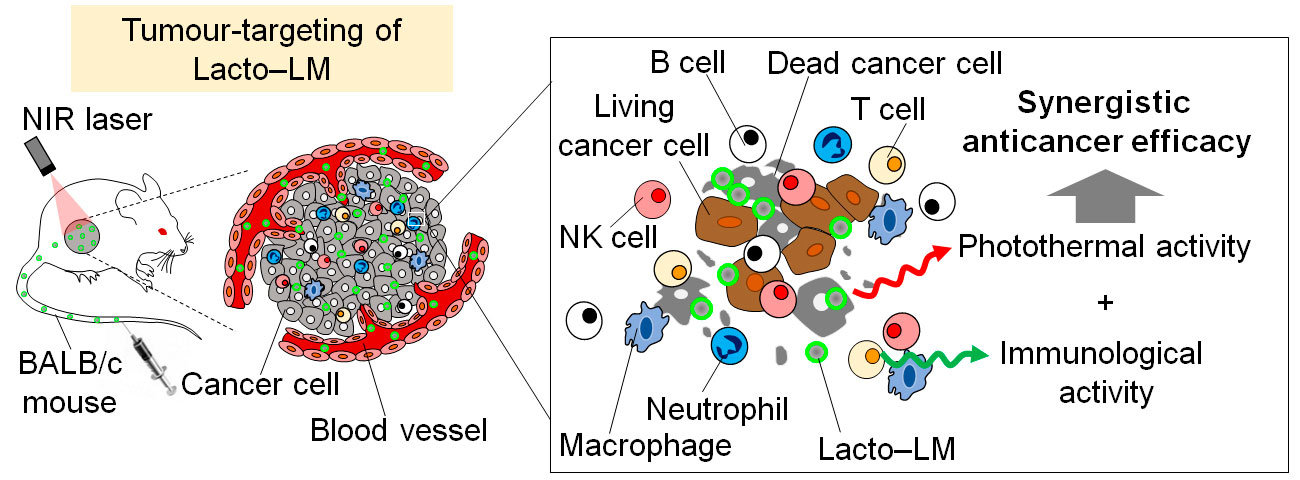
図1. 多機能性液体金属ナノ複合体を活用したがん光免疫療法の概念図
腫瘍内細菌叢の活用
近年の研究により、腫瘍組織内には固有の細菌叢(さいきんそう:細菌の集まり)が存在することが明らかになっています。都教授らは、これまでに腫瘍内から多種の細菌の単離に成功し、これらを活用したがん治療技術開発を進めてきました(既報プレスリリース:「阿吽の呼吸で癌を倒す!(※1)」「2種の細菌による新たながん治療へのアプローチ『AUN(阿吽)』を開発(※2)」)。
(※1)https://www.jaist.ac.jp/whatsnew/press/2023/05/08-1.html
(※2)https://www.jaist.ac.jp/whatsnew/press/2025/08/06-1.html
革新的ナノ複合体の創製
本研究チームは、Ga/In液体金属、乳酸菌成分、インドシアニングリーンを混合し、超音波照射するだけで球状ナノ粒子を形成する簡便な製法を確立しました。この手法により作製されたナノ複合体は以下の特性を示しました。
・高い安定性:7日以上の粒径安定性を維持
・優れた細胞親和性:高い膜浸透性と無毒性
・効率的光熱変換:近赤外光照射による発熱機能
卓越した治療効果の実証
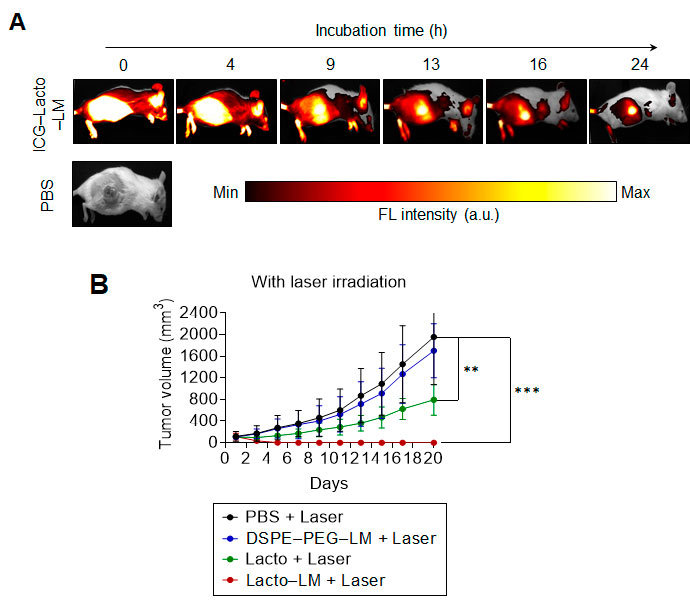
大腸がん移植マウスを用いた評価実験では、ナノ複合体の尾静脈投与24時間後、740~790 nmの近赤外光照射により、がん患部のみが鮮明に蛍光発光し、EPR効果による選択的腫瘍集積が確認されました(図2A)。
続いて808 nmの近赤外光を患部に照射(2日間隔で各5分間、計2回)したところ、免疫賦活化と光熱変換の相乗効果により、5日後にがんの完全消失を達成しました(図2B)。

| 図2. (A) 液体金属ナノ粒子の標的腫瘍内における蛍光特性 (B) 液体金属ナノ粒子による抗腫瘍効果(腫瘍は完全消失) |
対照実験の結果
乳酸菌単独投与:免疫賦活化によりある程度の抗腫瘍効果を確認
免疫非活性化ナノ粒子(ポリエチレングリコール-リン脂質複合体*6被覆):レーザー照射後も顕著な抗腫瘍効果なし
これらの結果から、乳酸菌成分による免疫賦活化と液体金属の光熱変換の相乗効果が、強力な抗腫瘍作用をもたらすことを明確に示しています。
優れた安全性の確認
細胞毒性試験:マウス大腸がん細胞(Colon26)およびヒト正常線維芽細胞(TIG103)において、ナノ複合体投与24時間後もミトコンドリア活性を指標とした細胞生存率に低下はなく、細胞毒性がないことを確認しました。
生体適合性試験:マウス静脈内投与後の血液検査(1週間)および体重測定(約1ヵ月)において、生体への悪影響は極めて軽微であることが判明しました。
【研究の意義と今後の展望】
本研究成果は、開発したナノ複合体が次世代がん診断・免疫療法の基盤技術となり得ることを実証するものです。さらに、ナノテクノロジー、光学、免疫学の学際的融合による材料設計の新たな技術基盤として、幅広い研究領域への貢献が期待されます。
今後は、他のがん種への適用拡大や臨床応用に向けた更なる安全性・有効性検証を進め、患者さんにより優しく効果的ながん治療法の実現を目指します。
【掲載誌情報】
本成果は、材料科学系トップジャーナル「Advanced Composites and Hybrid Materials」誌(Springer Nature社発行)に9月19日(現地時間)に掲載されました。
【研究支援】
本研究は、文部科学省科研費 基盤研究(A)(23H00551)、同 挑戦的研究(開拓)(22K18440、25K21827)、国立研究開発法人 科学技術振興機構(JST)大学発新産業創出基金事業 スタートアップ・エコシステム共創プログラム(JPMJSF2318)、本学超越バイオメディカルDX研究拠点ならびに本学生体機能・感覚研究センターの支援のもと行われたものです。
【論文情報】
| 掲載誌 | Advanced Composites and Hybrid Materials |
| 論文題目 | Bacterial-adjuvant liquid metal nanocomposites for synergistic photothermal immunotherapy |
| 著者 | Nina Sang, Seigo Iwata, Yun Qi, Eijiro Miyako* |
| 掲載日 | 2025年9月19日にオンライン版に掲載 |
| DOI | /10.1007/s42114-025-01434-7 |
【用語説明】
室温以下あるいは室温付近で液体状態を示す金属のこと。例えば、水銀(融点マイナス約39℃)、ガリウム(融点約30℃)、ガリウム-インジウム合金(融点約15℃)がある。
糖から乳酸を生成する性質を有する細菌の総称。本研究で用いた乳酸菌は都研究室にて腫瘍内から単離したものである。
肝機能検査に用いられる緑色色素のこと。近赤外レーザー光を照射すると近赤外蛍光と熱を発することができる。
100nm以下のサイズに粒径が制御された微粒子は、正常組織へは漏れ出さず、腫瘍血管からのみ、がん組織に到達して患部に集積させることが可能である。これをEPR効果(Enhanced Permeation and Retention Effect)という。
レーザーとは、光を増幅して放射するレーザー装置、またはその光のことである。レーザー光は指向性や収束性に優れており、発生する光の波長を一定に保つことができる。とくに700~1100 nmの近赤外領域の波長の光は生体透過性が高いことが知られている。
ポリエチレングリコールとリンを含有する脂質(脂肪)が結合した化学物質。脂溶性の薬剤を可溶化させる効果があり、ドラッグデリバリーシステムに良く利用される化合物の一つ。
令和7年9月25日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2025/09/25-1.html物質化学フロンティア研究領域の都教授らの総説論文がCell Biomaterialsに掲載
物質化学フロンティア研究領域の都 英次郎教授らの総説論文「生きた医薬(リビングドラッグ):治療応用における素晴らしい進化(Living Drugs: A Wonderful Evolution for Therapeutic Applications)」が、国際学術誌 Cell Biomaterials(Nature姉妹誌と同等レベルに格付けされているCell Pressの新興フラッグシップジャーナル)に掲載されました。
なお、本研究は、文部科学省 科学研究費補助金 基盤研究A(23H00551)、同 挑戦的研究(開拓)(22K18440、25K21827)、国立研究開発法人 科学技術振興機構(JST)研究成果最適展開支援プログラム(A-STEP)(JPMJTR22U1)、同 大学発新産業創出基金事業 スタートアップ・エコシステム共創プログラム(JPMJSF2318)、同 次世代研究者挑戦的研究プログラム(SPRING)未来創造イノベーション研究者支援プログラム(JPMJSP2102)、本学超越バイオメディカルDX研究拠点ならびに生体機能・感覚研究センターの支援のもと行われたものです。
掲載誌 :Cell Biomaterials
論文題目:Living Drugs: A Wonderful Evolution for Therapeutic Applications
著者 :Soudamini Chintalapati, Nina Sang, Mikako Miyahara, Seigo Iwata, Kei Nishida, Eijiro Miyako*
掲載日 :2025年9月8日にオンライン版に掲載
DOI :https://doi.org/10.1016/j.celbio.2025.100193
■論文概要
本総説では、細菌・ウイルス・ファージなどの「生きた医薬(Living Drugs)」が持つ治療応用の最前線と将来展望について包括的に解説しています。特に、がんや多剤耐性菌感染症において、これらの生物を利用した革新的治療法が急速に進展しており、免疫応答の回避、標的精度の向上、複合療法モデルの構築など、多様な技術的ブレークスルーが紹介されています。さらに、臨床応用に向けた課題として、投与方法や安全性評価、規制面での対応などが議論され、治療カテゴリーごとの将来方向性や研究優先課題についても提案しています。
本総説では、都研究室が開発を進めている2種の細菌による新たながん治療へのアプローチ「AUN(阿吽)」(プレスリリース参照)を用いた新規がん療法についても取り上げています。AUNは低酸素性腫瘍微小環境に選択的に集積・増殖し、免疫依存性と免疫非依存性の両経路を介して腫瘍を攻撃する自然由来の細菌療法です。特に、免疫不全状態でも効果を発揮し、腫瘍内血管の選択的破壊や細菌変形などによる直接的な腫瘍壊死誘導が確認されています。遺伝子改変を必要とせず高い安全性を維持できることから、臨床応用への展望が広がっています。
本総説は、Living Drugs研究の現状と課題、そして都研究室発のAUN療法を含む次世代治療の可能性を示す重要な指針となるものです。
プレスリリース詳細:2種の細菌による新たながん治療へのアプローチ「AUN(阿吽)」を開発 ―免疫不全状態でも機能が期待されるがん治療に向けて―
令和7年9月9日
出典:JAIST お知らせ https://www.jaist.ac.jp/whatsnew/info/2025/09/09-1.html都教授らの研究成果に関する記者発表を文部科学省で実施

8月4日(月)、物質化学フロンティア研究領域の都 英次郎教授は、「2種の細菌による新たながん治療へのアプローチ『AUN(阿吽)』を開発 ―免疫不全状態でも機能が期待されるがん治療に向けて」の研究成果について、文部科学省記者会見室にて記者発表を行いました。
本研究では、T細胞やB細胞などの免疫細胞の力に頼らずがんを制御する新しい治療へのアプローチ「AUN(阿吽)」を開発しました。このアプローチは、免疫不全状態にあるがん患者への新たな選択肢となる可能性があり、今後のさらなる研究と検証が期待されます。
記者発表では、都教授から研究・技術の背景や内容、今後の計画について説明がなされ、その後、記者との活発な質疑応答が行われました。
参加した記者からは、2種の細菌「AUN(阿吽)」によるがん治療のメカニズムや具体的な適用癌種、投与方法、副作用の管理、さらにはスタートアップ事業化に向けた今後の展望など、多岐にわたる質問が寄せられ、本研究への期待と関心の高さがうかがえました。
なお、本研究に関する論評がAdvanced Science誌に掲載されているほか、研究の背景やエピソードなどを紹介した記事がSpringer Nature Research Communities の「Behind the Paper」にて公開されています。ぜひご一読ください。
プレスリリース:2種の細菌による新たながん治療へのアプローチ「AUN(阿吽)」を開発 ―免疫不全状態でも機能が期待されるがん治療に向けて―

記者発表の様子
令和7年8月7日
出典:JAIST お知らせ https://www.jaist.ac.jp/whatsnew/info/2025/08/07-3.html物質化学フロンティア研究領域の都教授らの論文がSpringer Nature Research CommunitiesのBehind the Paperで紹介
物質化学フロンティア研究領域の都 英次郎教授らの最新の論文「2種の細菌による新たながん治療へのアプローチ『AUN(阿吽)』を開発―免疫不全状態でも機能が期待されるがん治療に向けて―」が、Springer Nature Research CommunitiesのBehind the Paperにて紹介されました。研究開発の発端、裏話などが紹介されています。なお、本研究は、文部科学省 科学研究費補助金 基盤研究A(23H00551)、同 挑戦的研究(開拓)(22K18440、25K21827)、国立研究開発法人 科学技術振興機構(JST) 研究成果最適展開支援プログラム(A-STEP)(JPMJTR22U1)、同 大学発新産業創出基金事業 スタートアップ・エコシステム共創プログラム(JPMJSF2318)、同 次世代研究者挑戦的研究プログラム(SPRING) 未来創造イノベーション研究者支援プログラム(JPMJSP2102)、公益財団法人 発酵研究所、公益財団法人 上原記念生命科学財団、本学超越バイオメディカルDX研究拠点、本学生体機能・感覚研究センターならびに第一三共株式会社の支援のもと行われたものです。
■論文概要
本研究では、2種類の細菌がまるで"阿吽の呼吸"のように精緻に連携しながら、がん細胞を選択的に攻撃するという新たな治療へのアプローチ「AUN(阿吽)」の開発に成功しました。
研究チームが用いたのは、"AUN(阿吽)"と名付けられた2種の天然細菌:腫瘍内に常在するProteus mirabilis[阿形(A-gyo)]と、光合成を行うRhodopseudomonas palustris[吽形(UN-gyo)]です。この互いに異なる機能を持つ2種の細菌が、それぞれの役割を果たしながら、以下の一連のプロセスを協調的に引き起こし、抗腫瘍効果を示すことが確認されました。まず、がん特有の環境に誘導されて、両細菌はマウス皮下腫瘍モデルにおいて腫瘍の血管やがん細胞を選択的に破壊。これにより、正常組織への影響を最小限に抑えつつ、がん組織だけを効果的に抑制する可能性が示唆されました。さらに、がんが産生する特異的な代謝物の存在下で、片方の細菌(A-gyo)は線維状の構造へと変化。この形態変化により抗腫瘍効果が一段と強化されることが判明しました。興味深いのは、経時的に両細菌の集団構成(ポピュレーション)も動的に変化し、最適な役割分担が自然に形成される点です。加えて、病原性を抑制しながら、重篤な副作用の原因となるサイトカインストームの発生も回避できる可能性があるという点も特徴です。
本研究は、2種の細菌の持つ自然な"協調戦略"を巧みに活用することで、安全かつ効果的ながん治療の新たな道を拓くものです。今後、このメカニズムを応用した新しいがん治療法の社会実装に向けて、スタートアップ創業を計画しています。
プレスリリース詳細:2種の細菌による新たながん治療へのアプローチ「AUN(阿吽)」を開発 ―免疫不全状態でも機能が期待されるがん治療に向けて―
令和7年8月7日
出典:JAIST お知らせ https://www.jaist.ac.jp/whatsnew/info/2025/08/07-2.html

