研究活動の検索
研究概要(研究室ガイド)やプレスリリース・受賞・イベント情報など、マテリアルサイエンスの研究室により公開された情報の中から、興味のある情報をタグや検索機能を使って探すことができます。物質化学フロンティア研究領域の都教授の論評がAdvanced Scienceに掲載
物質化学フロンティア研究領域の都 英次郎教授らの「阿吽の呼吸で癌を倒す! -灯台下暗し:最強の薬は腫瘍の中に隠されていた-」と「2種の細菌による新たながん治療へのアプローチ『AUN(阿吽)』を開発―免疫不全状態でも機能が期待されるがん治療に向けて―」に係る論評(Commentary)が、バイオ・化学系のトップジャーナルAdvanced Science誌に掲載されました。なお、本研究は、文部科学省 科学研究費補助金 基盤研究A(23H00551)、同 挑戦的研究(開拓)(22K18440、25K21827)、科学技術振興機構 大学発新産業創出基金事業 スタートアップ・エコシステム共創プログラム(JPMJSF2318)の支援のもと行われたものです。
掲載誌 :Advanced Science
論文題目:Reply to "Exploring Bacteria-Based Cancer Immunotherapy"-- Comment on "Discovery of Intratumoral Oncolytic Bacteria Toward Targeted Anticancer Theranostics"
著者 :Eijiro Miyako*
掲載日 :2025年7月14日(オンライン版)
DOI :https://doi.org/10.1002/advs.202511325
■概要
本研究では、2種類の細菌がまるで"阿吽の呼吸"のように精緻に連携しながら、がん細胞を選択的に攻撃するという新たな治療へのアプローチ「AUN(阿吽)」の開発に成功しました。
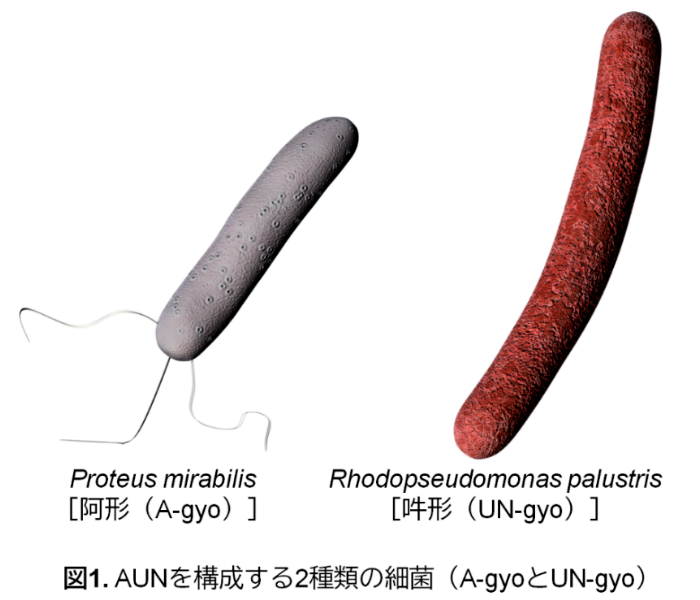
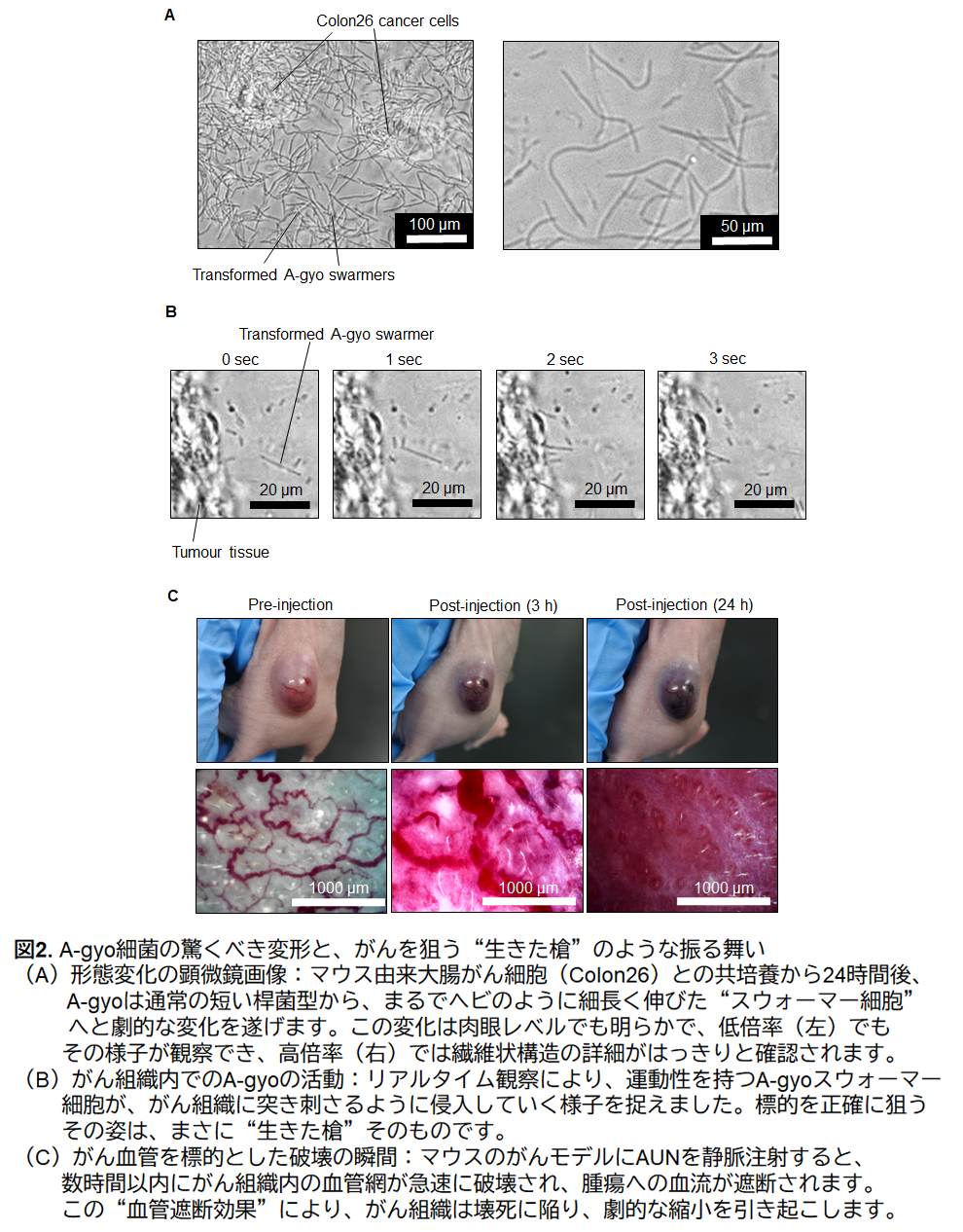
研究チームが用いたのは、"AUN(阿吽)"と名付けられた2種の天然細菌:腫瘍内に常在するProteus mirabilis[阿形(A-gyo)]と、光合成を行うRhodopseudomonas palustris[吽形(UN-gyo)]です。この互いに異なる機能を持つ2種の細菌が、それぞれの役割を果たしながら、以下の一連のプロセスを協調的に引き起こし、抗腫瘍効果を示すことが確認されました。まず、がん特有の環境に誘導されて、両細菌はマウス皮下腫瘍モデルにおいて腫瘍の血管やがん細胞を選択的に破壊。これにより、正常組織への影響を最小限に抑えつつ、がん組織だけを効果的に抑制する可能性が示唆されました。さらに、がんが産生する特異的な代謝物の存在下で、片方の細菌(A-gyo)は線維状の構造へと変化。この形態変化により抗腫瘍効果が一段と強化されることが判明しました。興味深いのは、経時的に両細菌の集団構成(ポピュレーション)も動的に変化し、最適な役割分担が自然に形成される点です。加えて、病原性を抑制しながら、重篤な副作用の原因となるサイトカインストームの発生も回避できる可能性があるという点も特徴です。
本研究は、2種の細菌の持つ自然な"協調戦略"を巧みに活用することで、安全かつ効果的ながん治療の新たな道を拓くものです。今後、このメカニズムを応用した新しいがん治療法の社会実装に向けて、スタートアップ創業を計画しています。
プレスリリース:阿吽の呼吸で癌を倒す! -灯台下暗し:最強の薬は腫瘍の中に隠されていた-
プレスリリース:2種の細菌による新たながん治療へのアプローチ「AUN(阿吽)」を開発 ―免疫不全状態でも機能が期待されるがん治療に向けて―
令和7年8月7日
出典:JAIST お知らせ https://www.jaist.ac.jp/whatsnew/info/2025/08/07-1.html2種の細菌による新たながん治療へのアプローチ「AUN(阿吽)」を開発 ―免疫不全状態でも機能が期待されるがん治療に向けて―
  |
北陸先端科学技術大学院大学 筑波大学 科学技術振興機構(JST) |
2種の細菌による新たながん治療へのアプローチ「AUN(阿吽)」を開発
―免疫不全状態でも機能が期待されるがん治療に向けて―
【ポイント】
- T細胞やB細胞などの主要な免疫細胞に依存せずにがん細胞を攻撃する、新しいがん治療へのアプローチ「AUN(阿吽)」を開発
- 免疫機能が低下した状態でも抗腫瘍効果が期待される
- 社会実装に向け、スタートアップ創業を視野に研究を推進中
| 北陸先端科学技術大学院大学(学長・寺野稔、石川県能美市)物質化学フロンティア研究領域の都 英次郎教授の研究グループは、第一三共株式会社(代表取締役社長兼CEO・奥澤宏幸、東京都中央区)ならびに筑波大学(学長・永田恭介、茨城県つくば市)生命環境系の高谷 直樹教授らとの共同研究によって、2種類の細菌がまるで"阿吽の呼吸"のように精緻に連携しながら、がん細胞を選択的に攻撃するという新たな治療へのアプローチ「AUN(阿吽)」の開発に成功しました。 研究チームが用いたのは、"AUN(阿吽)"と名付けられた2種の天然細菌:腫瘍内に常在するProteus mirabilis*1[阿形(A-gyo)]と、光合成を行うRhodopseudomonas palustris*2[吽形(UN-gyo)]です(図1)。この互いに異なる機能を持つ2種の細菌が、それぞれの役割を果たしながら、以下の一連のプロセスを協調的に引き起こし、抗腫瘍効果を示すことが確認されました(図2にメカニズムの一部を提示)。まず、がん特有の環境に誘導されて、両細菌はマウス皮下腫瘍モデルにおいて腫瘍の血管やがん細胞を選択的に破壊。これにより、正常組織への影響を最小限に抑えつつ、がん組織だけを効果的に抑制する可能性が示唆されました。さらに、がんが産生する特異的な代謝物の存在下で、片方の細菌(A-gyo)は線維状の構造へと変化。この形態変化により抗腫瘍効果が一段と強化されることが判明しました。興味深いのは、経時的に両細菌の集団構成(ポピュレーション)も動的に変化し、最適な役割分担が自然に形成される点です。加えて、病原性を抑制しながら、重篤な副作用の原因となるサイトカインストーム*3の発生も回避できる可能性があるという点も特徴です。 本研究は、2種の細菌の持つ自然な"協調戦略"を巧みに活用することで、安全かつ効果的ながん治療の新たな道を拓くものです。今後、このメカニズムを応用した新しいがん治療法の社会実装に向けて、スタートアップ創業を計画しています。 本成果は、2025年8月5日にSpringer Nature社の発行するNature Biomedical Engineering誌のオンライン版に掲載されました。 |

【研究の背景と内容】
がん免疫療法は、1868年にドイツの医師Buschが細菌感染を意図的に引き起こしたがん患者の治癒例を報告したことに端を発し、1893年にはWilliam Coley博士が「細菌を用いたがん治療法」を提唱して以来、150年以上にわたり発展を続けています。Coley博士は「がん免疫療法の父」と称され、彼の遺志は現代の免疫チェックポイント阻害剤やCAR-T細胞治療へと受け継がれています。
しかしこれまで、細菌療法を含むがん免疫療法は「免疫細胞の力」が不可欠とされてきました。また、化学療法や放射線治療などの標準治療を受けたがん患者の多くが免疫不全状態にあり、このような状況では、免疫細胞の力が抑えられるため、効果が著しく制限されてきました。
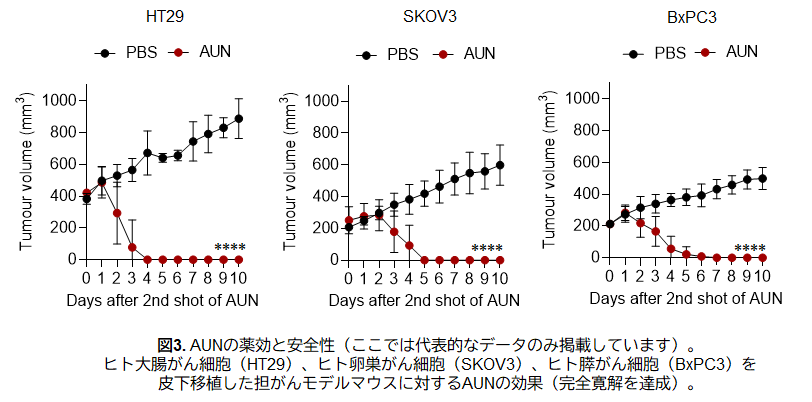
本研究では、T細胞やB細胞などの主要な免疫細胞に頼ることなくがんを攻撃する、世界でも類を見ない新しい治療へのアプローチを明らかにしました。登場するのは、"AUN(阿吽)"と名付けられた2種の天然細菌:腫瘍内に常在するProteus mirabilis[阿形(A-gyo)]と、光合成を行うRhodopseudomonas palustris[吽形(UN-gyo)]です。この2種が"阿吽の呼吸"で共存することで、各種ヒトがん細胞を皮下移植した担がんモデルマウスに対して明確な腫瘍抑制効果を発揮しました(図3)。
そのメカニズムは極めてユニークで、まさに"阿吽の呼吸"のように2つの細菌が協調し、以下のような一連の現象を連携して引き起こします(図2にメカニズムの一部を提示)。
- 腫瘍血管とがん細胞の選択的破壊
- がん代謝物による阿形(A-gyo)の構造変化(線維状化)による抗腫瘍強化
- 細菌間の構成比率の変化による機能最適化(ポピュレーションシフト)
- 病原性の抑制と副作用の回避(サイトカインストームの軽減)
さらに、吽形(UN-gyo)は、阿形(A-gyo)と共存・混在することによって、両者の病原性を抑制しながら、がん細胞に対する特異的な毒性を高める"制御役"として機能する可能性があります。この2種の細菌が示す絶妙なバランスと相互作用こそが、腫瘍抑制効果の鍵となっている可能性があります。
【社会的インパクト】
この治療へのアプローチは、免疫不全状態にあるがん患者への新たな選択肢となる可能性があり、今後のさらなる研究と検証が期待されます。実際に、本研究では免疫細胞が機能しにくいマウスモデルやヒトがんモデルにおいても、細菌が自律的にがん細胞および腫瘍血管を標的として作用する様子が確認されました。このようなT細胞やB細胞といった"免疫細胞に依存しない"方法は、従来のがん免疫療法とは異なるアプローチとして注目されています。
また、本成果の社会実装を見据え、がん細菌療法の実用化に向けたスタートアップの創業準備も進行中です。150年以上前から構想されてきたがん細菌療法の概念に、新たな技術的進展を加えることで、その応用可能性を慎重かつ段階的に検討していく段階に入っています。
【論文掲載情報など】
本成果は、2025年8月5日に医学・薬学系ジャーナルのNature Biomedical Engineering誌のオンライン版に掲載されました。なお、本研究は、文部科学省 科学研究費補助金 基盤研究A(23H00551)、同 挑戦的研究(開拓)(22K18440、25K21827)、国立研究開発法人 科学技術振興機構(JST) 研究成果最適展開支援プログラム(A-STEP)(JPMJTR22U1)、同 大学発新産業創出基金事業 スタートアップ・エコシステム共創プログラム(JPMJSF2318)、同 次世代研究者挑戦的研究プログラム(SPRING) 未来創造イノベーション研究者支援プログラム(JPMJSP2102)、公益財団法人 発酵研究所、公益財団法人 上原記念生命科学財団、本学超越バイオメディカルDX研究拠点、本学生体機能・感覚研究センターならびに第一三共株式会社の支援のもと行われました。
【論文情報】
| 掲載誌 | Nature Biomedical Engineering |
| 論文題目 | Tumour-resident oncolytic bacteria trigger potent anticancer effects through selective intratumoural thrombosis and necrosis |
| 著者 | Seigo Iwata1, Taisei Nishiyama1, Matomo Sakari1, Yuki Doi2, Naoki Takaya2, Yusuke Ogitani3, Hiroshi Nagano3, Keisuke Fukuchi3, Eijiro Miyako1* 1 北陸先端科学技術大学院大学 2 筑波大学 3 第一三共株式会社 |
| 掲載日 | 2025年8月5日にオンライン版に掲載 |
| DOI | 10.1038/s41551-025-01459-9 |
【用語説明】
酸素の存在下および不在下の両方の環境で生存可能な腸内細菌科に属するグラム陰性桿菌(通性嫌気性菌)。運動性、鞭毛を有する数マイクロメートルの棒状の形態を有する。寒天培地上では、Swarming(群化)により独特の波状のコロニー(白色)を形成する特性がある。
酸素の有無に関わらず生存可能な通性嫌気性の紅色非硫黄細菌に属し、運動性のある数マイクロメートルの棒状のグラム陰性桿菌。また、バクテリオクロロフィルから成る光捕集タンパク質を介した光合成を行う。
サイトカインストームとは、体がウイルスや細菌などに反応して免疫物質(サイトカイン)を大量に放出しすぎることで起こる、過剰な免疫反応のこと。この反応が強すぎると、自分自身の体の組織を傷つけてしまい、重い症状や臓器不全を引き起こすことがある。
令和7年8月6日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2025/08/06-1.html物質化学フロンティア研究領域の都教授らの論文がSmall Science誌の表紙に採択
物質化学フロンティア研究領域の都 英次郎教授らの「磁石と光で機能制御可能なナノ粒子の開発に成功!-高性能がん診断・治療に向けて-」に係る論文が、生物・化学系のトップジャーナルSmall Science誌の表紙に採択されました。本研究は、文部科学省科研費 基盤研究(A)(23H00551)、文部科学省科研費 挑戦的研究(開拓)(22K18440)、国立研究開発法人科学技術振興機構(JST) 研究成果最適展開支援プログラム (A-STEP)(JPMJTR22U1)、大学発新産業創出基金事業スタートアップ・エコシステム共創プログラム(JPMJSF2318)ならびに本学超越バイオメディカルDX研究拠点、本学生体機能・感覚研究センターの支援のもと行われたものです。
■掲載誌
Small Science, Volume 5, No. 5
掲載日:2025年5月4日
■著者
Yun Qi, Eijiro Miyako*
■論文タイトル
Multifunctional Magnetic Ionic Liquid-Carbon Nanohorn Complexes for Targeted Cancer Theranostics
■論文概要
本研究では、カーボンナノホーン表面に磁性イオン液体、近赤外蛍光色素(インドシアニングリーン)、分散剤(ポリエチレングリコール-リン脂質複合体)を被覆したナノ粒子の作製に成功しました。得られたナノ粒子は、ナノ粒子特有のEPR効果のみならず、磁性イオン液体に由来する磁場駆動の腫瘍標的能によって、大腸がんを移植したマウス体内の腫瘍内に効果的に集積し、磁性イオン液体に由来する抗がん作用に加え、生体透過性の高い近赤外レーザー光により、インドシアニングリーンに由来するがん患部の可視化とカーボンナノホーンに由来する光熱変換による多次元的な治療が可能であることを実証しました。さらに、マウスを用いた生体適合性試験などを行い、いずれの検査からもナノ粒子が生体に与える影響は極めて少ないことがわかりました。当該ナノ粒子と近赤外レーザー光を組み合わせた新たながん診断・治療技術の創出が期待されます。
表紙詳細:https://onlinelibrary.wiley.com/doi/10.1002/smsc.202570019
論文詳細:https://onlinelibrary.wiley.com/doi/full/10.1002/smsc.202400640
プレスリリース詳細:https://www.jaist.ac.jp/whatsnew/press/2025/03/06-1.html
令和7年5月8日
出典:JAIST お知らせ https://www.jaist.ac.jp/whatsnew/info/2025/05/08-2.html物質化学フロンティア研究領域の都教授らの論文がAdvanced Science誌の最も閲覧された論文の上位10%にランクインされました

物質化学フロンティア研究領域の都 英次郎教授らの「阿吽の呼吸で癌を倒す! -灯台下暗し:最強の薬は腫瘍の中に隠されていた-」に係る論文が、生物・化学系トップジャーナルAdvanced Science誌の最も閲覧された論文の上位10%にランクインしました。なお、本研究は、文部科学省科研費 基盤研究(A)(23H00551)、文部科学省科研費 挑戦的研究(開拓)(22K18440)、国立研究開発法人科学技術振興機構(JST) 研究成果最適展開支援プログラム (A-STEP)(JPMJTR22U1)、公益財団法人発酵研究所、公益財団法人上原記念生命科学財団、ならびに本学超越バイオメディカルDX研究拠点、本学生体機能・感覚研究センターの支援のもと行われたものです。
■掲載誌
Advanced Science
■著者
Yamato Goto, Seigo Iwata, Mikako Miyahara, Eijiro Miyako*
■論文タイトル
Discovery of intratumoral oncolytic bacteria toward targeted anticancer theranostics
■論文概要
本研究では、マウス生体内の大腸癌由来腫瘍組織から主に3種類の細菌の単離・同定に成功し、これらの細菌にA-gyo(阿形;Proteus mirabilis)、UN-gyo(吽形;Rhodopseudomonas palustris)、そしてAUN(阿吽;A-gyoとUN-gyoから成る複合細菌)とそれぞれ命名しました。これらの細菌を、大腸癌を皮下移植した担癌モデルマウスの尾静脈に投与したところ、低酸素状態の腫瘍環境内で高選択的に集積・生育・増殖が可能で、かつ高い抗腫瘍効果を示すことを発見しました。とりわけ、AUNは、単回投与にも関わらず、A-gyoとUN-gyoの協奏作用により細胞障害性の免疫細胞を効果的に賦活化し、大腸癌、肉腫(サルコーマ)、転移性肺癌、薬物耐性乳腺癌といった様々な癌種に対して強力な抗腫瘍活性を示すことが明らかとなりました。また、AUNは、生体透過性の高い近赤外光によって標的とする腫瘍内で近赤外蛍光を発現することが分かりました。さらに、マウスを用いた生体適合性試験(血液学的検査、組織学的検査、細菌コロニーアッセイなど)を行った結果、いずれの検査からもAUNそのものが生体に与える影響は極めて少ないことが分かりました。これらの成果は、今回発見した細菌を用いた癌の診断・治療法の基礎に成り得るだけでなく、細菌学や腫瘍微生物学などの研究領域への新しい概念の創出として貢献することを期待させるものだと考えられます。
論文詳細:https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202301679
プレスリリース詳細:https://www.jaist.ac.jp/whatsnew/press/2023/05/08-1.html

令和7年4月17日
出典:JAIST お知らせ https://www.jaist.ac.jp/whatsnew/info/2025/04/17-2.html細菌成分をコーティングした酸化グラフェンナノ複合体の創出! -多機能性を発現可能ながん光免疫療法の実現に向けて-

細菌成分をコーティングした酸化グラフェンナノ複合体の創出!
-多機能性を発現可能ながん光免疫療法の実現に向けて-
【ポイント】
- 細菌成分と酸化グラフェンから成るナノ複合体の作製に成功
- 当該ナノ複合体のEPR効果により標的とする腫瘍内に効果的に集積し、マウスに移植したがんの可視化と、免疫賦活化、抗がん作用、光熱変換によるがん治療が可能であることを実証
- 当該ナノ粒子と近赤外光を組み合わせた新たながん診断・治療技術の創出に期待
| 北陸先端科学技術大学院大学(学長・寺野 稔、石川県能美市)物質化学フロンティア研究領域の都 英次郎教授らは、酸化グラフェン*1表面に細菌成分、近赤外蛍光色素(インドシアニングリーン*2)、抗がん剤(カンプトテシン*3)を被覆したナノ複合体の作製に成功した(図1)。得られたナノ複合体は、ナノ複合体特有のEPR効果*4に由来する腫瘍標的能によって、大腸がんを移植したマウス体内の腫瘍内に効果的に集積し、細菌成分による免疫賦活化とカンプトテシンに由来する抗がん作用に加え、生体透過性の高い近赤外レーザー光*5により、インドシアニングリーンに由来するがん患部の可視化と酸化グラフェンに由来する光熱変換による多次元的な治療が可能であることを実証した。さらに、マウスを用いた生体適合性試験などを行い、いずれの検査からもナノ複合体が生体に与える影響は極めて少ないことがわかった。当該ナノ複合体と近赤外レーザー光を組み合わせた新たながん光免疫治療技術の創出が期待される。 |
【研究背景と内容】
ナノ炭素材料の一つである酸化グラフェン(GO)は、優れた物理化学的特性を有することが知られており、とりわけ素材開発の分野で注目を集めている。都教授は、ナノ炭素材料が生体透過性の高い波長領域(650~1100 nm)のレーザー光により容易に発熱する特性(光発熱特性)を活用したがん診断・治療技術の開発を推進している(※1、※2、※3、※4)。
(※1) https://www.jaist.ac.jp/whatsnew/press/2020/04/23-1.html
(※2) https://www.jaist.ac.jp/whatsnew/press/2020/08/17_2.html
(※3) https://www.jaist.ac.jp/whatsnew/press/2024/08/22-1.html
(※4) https://www.jaist.ac.jp/whatsnew/press/2025/03/06-1.html
一方、腫瘍組織内に細菌が存在していることは古くから知られており、近年の研究では、腫瘍の種類ごとに独自の細菌叢が保有されていることが分かっている。また、このような腫瘍内細菌叢が抗癌剤の補助あるいは阻害の要因になっていることも明らかになっている。しかし、腫瘍内から直接細菌を取り出し、細菌そのものを癌の治療薬として活用する研究は皆無であった。このような経緯の中、都研究室では、マウス生体内の腫瘍組織から数多くの細菌の単離・同定に成功しており、これらの細菌を活用したがん診断・治療技術の開発を進めている(※5)。
(※5) https://www.jaist.ac.jp/whatsnew/press/2023/05/08-1.html
本研究では、光発熱素材であるGOと超音波照射によりホモジナイズ*6した腫瘍内細菌(Cutibacterium acnes)成分を複合化した新規ナノ複合体を開発し、がん診断・治療技術への可能性を調査した(図1)。より具体的には、C. acnes(CA)成分、近赤外蛍光色素[インドシアニングリーン(ICG)]、抗がん剤[カンプトテシン(CPT)]を被覆したGO(ICG-CPT-CA-GO複合体)をがん患部に同時に送り込むことで、CAに由来する免疫賦活化作用とCPTに由来する抗がん作用に加え、生体透過性の高い近赤外レーザー光を用いることで、ICGに由来する近赤外蛍光特性を用いた患部の可視化やGOに由来する光熱変換を利用した、新たながんの診断や治療法の開発に成功した。また、ICG-CPT-CA-GO複合体をマウスの静脈から投与し、生体適合性を組織学的検査、血液検査、体重測定により評価したが、いずれの項目でもICG-CPT-CA-GO複合体が生体に与える影響は極めて少ないことがわかった。
これらの成果は、今回開発したICG-CPT-CA-GO複合体が、革新的がん診断・治療法の基礎に成り得ることを示すだけでなく、ナノテクノロジーや光学といった幅広い研究領域における材料設計の技術基盤として貢献することを十分期待させるものである。
本成果は、2025年3月21日に炭素系材料の国際専門トップジャーナル「Carbon」誌(Elsevier発行)のオンライン版に掲載された。なお、本研究は、文部科学省科研費 基盤研究(A)(23H00551)、文部科学省科研費 挑戦的研究(開拓)(22K18440)、国立研究開発法人科学技術振興機構(JST) 研究成果最適展開支援プログラム (A-STEP)(JPMJTR22U1)、大学発新産業創出基金事業スタートアップ・エコシステム共創プログラム(JPMJSF2318)ならびに本学超越バイオメディカルDX研究拠点、本学生体機能・感覚研究センターの支援のもと行われたものである。
 図1. 様々な機能性分子を被覆したナノ複合体の作製(超音波処理するだけで簡便に作製可能)。
図1. 様々な機能性分子を被覆したナノ複合体の作製(超音波処理するだけで簡便に作製可能)。
【論文情報】
| 掲載誌 | Carbon |
| 論文題目 | Hybrid Nanoarchitectonics with Bacterial Component-Integrated Graphene Oxide for Cancer Photothermo-Chemo-Immunotherapy |
| 著者 | Soudamini Sai Vimala Veera Chintalapati, Eijiro Miyako* |
| 掲載日 | 2025年3月21日にオンライン版に掲載 |
| DOI | 10.1016/j.carbon.2025.120252 |
【用語説明】
酸化グラフェンとは、黒鉛を酸化させることにより得られ、厚さはおよそ 1 nmのシート状の素材。高い表面積を有し、表面に存在する酸素官能基により親水性や電気絶縁性を示す。
肝機能検査に用いられる緑色色素のこと。近赤外レーザー光を照射すると近赤外蛍光と熱を発することができる。
植物のカンレンボク Camptotheca acuminata に含まれるアルカロイドの一種。抗がん作用を示す。
100nm以下のサイズに粒径が制御された微粒子は、正常組織へは漏れ出さず、腫瘍血管からのみ、がん組織に到達して患部に集積させることが可能である。これをEPR効果(Enhanced Permeation and Retention Effect)という。
レーザーとは、光を増幅して放射するレーザー装置、またはその光のことである。レーザー光は指向性や収束性に優れており、発生する光の波長を一定に保つことができる。とくに700~1100 nmの近赤外領域の波長の光は生体透過性が高いことが知られている。
均質化すること。特に、生物の細胞や組織などを人工的に破砕、均質化することをさす。眼鏡の洗浄に利用される超音波照射装置が均質化に良く利用される。
令和7年3月27日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2025/03/27-1.html磁石と光で機能制御可能なナノ粒子の開発に成功! -高性能がん診断・治療に向けて-

磁石と光で機能制御可能なナノ粒子の開発に成功!
-高性能がん診断・治療に向けて-
【ポイント】
- 磁性イオン液体とカーボンナノホーンから成る複合体の作製に成功
- 当該ナノ粒子の磁場応答性とEPR効果により標的とする腫瘍内に効果的に集積し、マウスに移植したがんの可視化と、抗がん作用、光熱変換によるがん治療が可能であることを実証
- 当該ナノ粒子と近赤外光を組み合わせた新たながん診断・治療技術の創出に期待
| 北陸先端科学技術大学院大学(学長・寺野 稔、石川県能美市)物質化学フロンティア研究領域の都 英次郎教授らは、カーボンナノホーン*1表面に磁性イオン液体*2、近赤外蛍光色素(インドシアニングリーン*3)、分散剤(ポリエチレングリコール-リン脂質複合体*4)を被覆したナノ粒子の作製に成功した(図1)。得られたナノ粒子は、ナノ粒子特有のEPR効果*5のみならず、磁性イオン液体に由来する磁場駆動の腫瘍標的能によって、大腸がんを移植したマウス体内の腫瘍内に効果的に集積し、磁性イオン液体に由来する抗がん作用に加え、生体透過性の高い近赤外レーザー光*6により、インドシアニングリーンに由来するがん患部の可視化とカーボンナノホーンに由来する光熱変換による多次元的な治療が可能であることを実証した。さらに、マウスを用いた生体適合性試験などを行い、いずれの検査からもナノ粒子が生体に与える影響は極めて少ないことがわかった。当該ナノ粒子と近赤外レーザー光を組み合わせた新たながん診断・治療技術の創出が期待される。 |
【研究背景と内容】
がんは世界における死亡の主な原因の1つである。世界保健機関 (WHO) によると、2020年には約1,000万人のがん患者が亡くなっている。とりわけ先進国の人口の高齢化と生活習慣の要因により、症例数は引き続き増加すると予想されている。科学、技術、社会の発展が大きく進歩したにもかかわらず、従来の抗がん剤の特異性の低さ、重篤な副作用、転移性疾患に対する有効性の限界などが相まって、がんは依然として重要かつ世界的な健康課題となっている。従って、より効果的かつ安心・安全な先進がん診断・治療技術の開発は急務である。
イオン液体は、低融点、低揮発性、高イオン濃度、高イオン伝導性などの特長を持つ室温で液体として存在する塩であり、コンデンサ用電解液や帯電防止剤、CO2吸収剤などの様々な産業用途に応用されており、とりわけ環境・エネルギー分野で注目されている。また、近年イオン液体に抗がん作用があることが見出されており、上記の分野のみならず医療分野への応用展開も期待されている。
そもそもイオン液体という物質は、陽イオン分子と陰イオン分子という極めてシンプルな2種類の構成要素で成り立っている。つまり、陽イオン側と陰イオン側の両方に多様な可能性があることから、両者の組み合わせとなるイオン液体には、膨大な種類が存在しうることになる。そのためイオン液体は「デザイナー溶媒」と呼ばれている。例えば、陽イオンが1-ブチル-3-メチルイミダゾリウム、陰イオンが塩化鉄であるイオン液体([Bmin][FeCl4])は、ネオジム磁石程度の磁場に応答する「磁性イオン液体」として知られている。磁石に反応する流体としては、この磁性イオン液体の他に、磁性流体という粉末磁石を懸濁させた油などが知られている。しかし、従来の磁性流体は、固体と液体に分離してしまいやすく不安定であった。磁性イオン液体は極めて安定であり、揮発せず、燃えないなどのイオン液体特有の性質を保持している。このため磁性イオン液体は、固体磁石にはできなかった液体磁石の新しい用途に向けて応用が期待されている。しかし、このような磁性イオン液体の高い潜在能力に反して、これまで報告されている磁性イオン液体の応用例は、化学物質の抽出や分離に限られていた。
一方、ナノ炭素材料の一つであるカーボンナノホーン(CNH)は、高い生体適合性と優れた物理化学的特性を有することが知られており、とりわけバイオメディカル分野で大きな注目を集めている。都教授は、CNHが生体透過性の高い波長領域(650~1100 nm)のレーザー光により容易に発熱する特性(光発熱特性)を世界に先駆けて発見し、当該光発熱特性を活用したがん診断・治療技術の開発を推進している(※1)。また、都研究室では、革新的がん診断・治療技術に向けてCNHのさらなる高性能化・高機能化に取り組んでいる(※2)。
(※1) https://www.jaist.ac.jp/whatsnew/press/2020/08/17_2.html
(※2) https://www.jaist.ac.jp/whatsnew/press/2024/08/22-1.html
本研究では、磁性イオン液体([Bmin][FeCl4])と光発熱素材(CNH)を複合化した新規ナノ粒子を開発し、がん診断・治療技術への可能性を調査した。より具体的には、[Bmin][FeCl4]、近赤外蛍光色素(インドシアニングリーン)、分散剤(ポリエチレングリコール-リン脂質複合体)を被覆したCNH([Bmin][FeCl4]‒PEG‒ICG‒CNH複合体)をがん患部に同時に送り込むことで、[Bmin][FeCl4]に由来する磁場応答性と抗がん作用に加え、生体透過性の高い近赤外レーザー光を用いることで、インドシアニングリーンに由来する近赤外蛍光特性を用いた患部の可視化やCNHに由来する光熱変換を利用した、新たながんの診断や治療の実現を目指した。
当該目標を達成するために、今回開発した技術では、簡便な超音波照射によって[Bmin][FeCl4]、近赤外蛍光色素(インドシアニングリーン)、ポリエチレングリコール-リン脂質複合体をCNH表面に吸着させることで、CNHを水溶液中に分散できるようにした(図1)。この方法で作製した[Bmin][FeCl4]‒PEG‒ICG‒CNH複合体は、7日以上の粒径安定性を有していること、細胞に対し高い膜浸透性を有し抗がん作用を発現すること、近赤外レーザー光照射により発熱が起こることが確認できたため、がん患部の可視化と治療効果について試験を行った。
大腸がんを移植して約10日後のマウスに、当該[Bmin][FeCl4]‒PEG‒ICG‒CNH複合体を尾静脈から投与し、医療用バンデージを使って患部に小型のネオジウム磁石を24時間張り付けた後に740~790 nmの近赤外光を当てたところ、がん患部が蛍光を発している画像が得られた(図2A)。また、当該ナノ粒子が、ネオジウム磁石を用いない場合や磁性イオン液体を被覆していないナノ粒子(PEG‒ICG‒CNH複合体)に比較して、がん組織に効果的に取り込まれていることが分かった(図2A)。そこで、当該ナノ粒子([Bmin][FeCl4]‒PEG‒ICG‒CNH複合体 + 磁場)が集積した患部に対して808 nmの近赤外レーザー光を照射したところ、[Bmin][FeCl4]に由来する抗がん作用に加え、CNHの光熱変換による効果で5日後には、がんを完全に消失させることが判明した(図2B)。
一方、腫瘍内における薬効メカニズムを組織学的評価により調査したところ、とりわけ磁場印可とレーザー照射した[Bmin][FeCl4]‒PEG‒ICG‒CNH複合体においてがん細胞組織の顕著な破壊が起こることが明らかとなった。
さらに、[Bmin][FeCl4]‒PEG‒ICG‒CNH複合体をマウスの静脈から投与し、生体適合性を組織学的検査、血液検査、体重測定により評価したが、いずれの項目でも[Bmin][FeCl4]‒PEG‒ICG‒CNH複合体が生体に与える影響は極めて少ないことがわかった。
これらの成果は、今回開発した[Bmin][FeCl4]‒PEG‒ICG‒CNH複合体が、革新的がん診断・治療法の基礎に成り得ることを示すだけでなく、ナノテクノロジーや光学といった幅広い研究領域における材料設計の技術基盤として貢献することを十分期待させるものである。
本成果は、2025年3月3日に生物・化学系のトップジャーナル「Small Science」誌(Wiley発行)のオンライン版に掲載された。なお、本研究は、文部科学省科研費 基盤研究(A)(23H00551)、文部科学省科研費 挑戦的研究(開拓)(22K18440)、国立研究開発法人科学技術振興機構(JST) 研究成果最適展開支援プログラム (A-STEP)(JPMJTR22U1)、大学発新産業創出基金事業スタートアップ・エコシステム共創プログラム(JPMJSF2318)ならびに本学超越バイオメディカルDX研究拠点、本学生体機能・感覚研究センターの支援のもと行われたものである。
 図1.様々な機能性分子を被覆したナノ粒子の作製と本研究の概念。
図1.様々な機能性分子を被覆したナノ粒子の作製と本研究の概念。
CNH: カーボンナノホーン、ICG: インドシアニングリーン、[Bmim][FeCl4]: 磁性イオン液体、
DSPE‒PEG2000‒NH2: ポリエチレングリコール-リン脂質複合体。
 図2. ナノ粒子をがん患部に集積・可視化(A)し、光照射によりがんを治療(B)
図2. ナノ粒子をがん患部に集積・可視化(A)し、光照射によりがんを治療(B)
(赤色の囲いは腫瘍の位置、赤色の矢印は消失した腫瘍の位置をそれぞれ示している)。
【論文情報】
| 掲載誌 | Small Science |
| 論文題目 | Multifunctional magnetic ionic liquid-carbon nanohorn complexes for targeted cancer theranostics |
| 著者 | Yun Qi, Eijiro Miyako* |
| 掲載日 | 2025年3月3日にオンライン版に掲載 |
| DOI | 10.1002/smsc.202400640 |
【用語説明】
飯島澄男博士らのグループが1998年に発見したカーボンナノチューブの一種。直径は2~5 nm、長さ40~50 nmで不規則な形状を持つ。数千本が寄り集まって直径100 nm程度の球形集合体を形成している。とりわけ、薬品の輸送用担体として期待されており、バイオメディカル分野で注目を集めている。
磁気力によってイオンが移動する液体。
肝機能検査に用いられる緑色色素のこと。近赤外レーザー光を照射すると近赤外蛍光と熱を発することができる。
ポリエチレングリコールとリンを含有する脂質(脂肪)が結合した化学物質。脂溶性の薬剤を可溶化させる効果があり、ドラッグデリバリーシステムによく利用される化合物の一つ。
100nm以下のサイズに粒径が制御された微粒子は、正常組織へは漏れ出さず、腫瘍血管からのみ、がん組織に到達して患部に集積させることが可能である。これをEPR効果(Enhanced Permeation and Retention Effect)という。
レーザーとは、光を増幅して放射するレーザー装置、またはその光のことである。レーザー光は指向性や収束性に優れており、発生する光の波長を一定に保つことができる。とくに700~1100 nmの近赤外領域の波長の光は生体透過性が高いことが知られている。
令和7年3月6日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2025/03/06-1.html金沢大学・北陸先端科学技術大学院大学 第4回共同シンポジウム with 第16回ライフサイエンス研究交流セミナーを開催
令和7年2月3日(月)、金沢大学自然科学系図書館棟1階大会議室において、金沢大学・北陸先端科学技術大学院大学 第4回共同シンポジウム with 第16回ライフサイエンス研究交流セミナーを開催しました。
金沢大学と本学は、平成30年度より融合科学共同専攻における分野融合型研究を推進してきましたが、昨年度より、融合科学共同専攻の活動にとどまらず、両大学間の共同研究の発展と促進を目的に共同シンポジウムを開催しており、今回は4回目の開催となりました。また今回は、金沢大学内で平成27年度から定期的に開催してきたライフサイエンス研究交流セミナーとの合同開催とし、ポスターセッションを開催しました。
「健康長寿」をテーマに開催した今回の共同シンポジウムは、金沢大学 和田隆志 学長による開会挨拶後、がん治療や老化細胞の解析等に係る先進的な研究開発および両学間での共同研究の成果等について、本学 物質化学フロンティア研究領域 栗澤元一 教授、金沢大学 がん進展制御研究所長 鈴木健之 教授、本学 物質化学フロンティア研究領域 都英次郎 教授、金沢大学 がん進展制御研究所 城村由和 教授にそれぞれご講演いただき、本学 寺野稔 学長の挨拶をもって閉会となりました。
また、共同シンポジウム終了後、ライフサイエンス研究交流セミナーとして、両大学の若手研究者・学生によるポスターセッションが開催され、ライフサイエンス分野に係る自身の研究成果の発表を通じ、他研究者との活発な意見交換が行われました。リラックスした空間の中、多くの研究者が積極的に情報交換を行い、異分野の研究者との研究交流も促進される大変有意義な機会となりました。
今後とも本シンポジウムが両大学間の共同研究発展の端緒となるよう推進して参ります。

開会の挨拶をする和田学長

シンポジウムの様子

講演①「難治性疾患治療を変える薬効増幅型緑茶カテキン・ナノ粒子の開発」栗澤 元一 教授(本学 物質化学フロンティア研究領域、 超越バイオメディカルDX研究拠点)

講演②「がん悪性進展におけるエピゲノム・エピトランスクリプトーム制御の解明に向けて」鈴木 健之 教授(金沢大学 がん進展制御研究所 所長)

講演③「光細菌を利用したがん診断・治療技術」都 英次郎 教授(本学 物質化学フロンティア研究領域、 超越バイオメディカルDX研究拠点)

講演④「革新的な健康寿命延伸法創出に向けた老化細胞多様性の包括的解明」城村 由和 教授(金沢大学 がん進展制御研究所)

閉会のあいさつをする寺野学長

ポスターセッションの様子①

ポスターセッションの様子②
令和7年2月12日
出典:JAIST お知らせ https://www.jaist.ac.jp/whatsnew/info/2025/02/12-1.htmlInternational Symposium on Exponential Biomedical DX 2024を開催
2024年12月19日から20日にかけて、本学 超越バイオメディカルDX研究拠点主催の第1回国際シンポジウム「International Symposium on Exponential Biomedical DX 2024(eMEDX-24)」を石川ハイテク交流センターにて開催しました。本シンポジウムでは、「ウェルビーイングの実現」をテーマに、バイオメディカルサイエンス・テクノロジーの最前線で活躍する国内外の研究者・科学者が一堂に会し、多岐にわたるテーマについて自由闊達な議論が展開されました。参加者は総勢148名に上り、基調講演4件、特別講演9件、招待講演32件が行われました。
本学の寺野 稔 学長および大会長である超越バイオメディカルDX研究拠点長の松村 和明 教授による開会挨拶の後、東京女子医科大学 岡野 光夫 名誉教授と亜洲大学校 キ・ドン・パク 教授による基調講演が行われました。岡野名誉教授は温度応答性高分子材料の研究、パク教授は生理活性ヒドロゲルの研究について、それぞれ医療分野への応用を含めた最先端の成果を発表し、参加者の大きな関心を引きました。続いて、バイオメディカル分野で活躍するトップランナーの研究者による特別講演や招待講演が行われ、参加者同士の活発な意見交換が展開されました。また、北陸三県のバイオメディカル研究室に所属するJST次世代研究者挑戦的研究プログラム(SPRING)に採択された博士後期課程の学生が主催する特別セッションでは、博士号取得後のキャリアプランについて熱心な議論が交わされました。
二日目には、京都大学 秋吉 一成 名誉教授と韓国科学技術研究院 クァン・リョル・リー 博士による基調講演が行われました。秋吉名誉教授はバイオインスパイアードナノマテリアルを活用したドラッグデリバリーシステムの開発について、また、リー博士はマテリアルズR&Dデータにおけるスキーマおよび語彙の標準化に関する研究成果について講演されました。その後、バイオメディカル分野を牽引する第一線の研究者による特別講演や招待講演が続き、参加者間では熱心な議論や意見交換が行われました。また、国内外の学生による最新の研究に関するポスター発表(49件)が行われ、活発なディスカッションが繰り広げられました。その結果、4名の学生が最優秀学生ポスター賞を、8名の学生が優秀学生ポスター賞を受賞し、授賞式が執り行われました。その後、本学超越バイオメディカルDX研究拠点の栗澤 元一 教授および都 英次郎 教授による挨拶で締めくくられ、盛況のうちに終了しました。
本シンポジウムの開催を契機に、ウェルビーイングの実現に向けて、超越バイオメディカルDX研究のさらなる加速を目指して邁進してまいります。


開会の挨拶をする寺野 稔 学長(左)と
松村 和明 超越バイオメディカルDX研究拠点長

基調講演①
岡野 光夫 名誉教授
(東京女子医科大学)

基調講演②
キ・ドン・パク 教授
(亜州大学校)

基調講演③
秋吉 一成 名誉教授
(京都大学)

基調講演④
クァン・リョル・リー 博士
(韓国科学技術研究院)

SPRING主催特別セッション

ポスター発表

優秀学生ポスター賞受賞式


閉会の挨拶をする栗澤 元一 教授(左)と
都 英次郎 教授(右)

シンポジウムの様子
令和6年12月27日
出典:JAIST お知らせ https://www.jaist.ac.jp/whatsnew/info/2024/12/27-1.html第4回 金沢大学・北陸先端科学技術大学院大学 共同シンポジウム with 第16回ライフサイエンス研究交流セミナー
本学と金沢大学は、平成30年度より融合科学共同専攻における分野融合型研究を推進してきましたが、昨年度からは融合科学共同専攻にとどまらず、両大学間の共同研究の発展と促進を目指すことを目的に、共同シンポジウムを開催しています。
第4回である今回のテーマは『健康長寿』です。また当日は、金沢大学のライフサイエンス研究交流セミナーとの合同開催によるポスターセッションと懇談会も開催します。多数のご参加をお待ちしています。
| 開催日時 | 令和7年2月3日(月)13:30~18:00 |
| 会 場 | 金沢大学自然科学系図書館棟1階大会議室(金沢市角間町) ※第1部(共同シンポジウム)のみWebexにて同時配信 |
| テーマ | 健康長寿 |
| プログラム | ≪第1部:共同シンポジウム≫ 13:30~ オープニング(本シンポジウムの趣旨説明等) 13:35~ 開会挨拶 金沢大学 和田 隆志 学長 13:40~14:20 ≪講演1≫ *講演:30分、質疑応答:10分 講演者:栗澤 元一 教授 (本学 物質化学フロンティア研究領域、超越バイオメディカルDX研究拠点) 講演タイトル:難治性疾患治療を変える薬効増幅型緑茶カテキン・ナノ粒子の開発 14:25~15:05 ≪講演2≫ *講演:30分、質疑応答:10分 講演者:鈴木 健之 教授(金沢大学 がん進展制御研究所長) 講演タイトル:がん悪性進展におけるエピゲノム・エピトランスクリプトーム制御の解明に向けて 15:25~16:05 ≪講演3≫ *講演:30分、質疑応答:10分 講演者:都 英次郎 教授 (本学 物質化学フロンティア研究領域、超越バイオメディカルDX研究拠点) 講演タイトル:光細菌を利用したがん診断・治療技術 16:10~16:50 ≪講演4≫ *講演:30分、質疑応答:10分 講演者: 城村 由和 教授(金沢大学 がん進展制御研究所) 講演タイトル:革新的な健康寿命延伸法創出に向けた老化細胞多様性の包括的解明 16:50~16:55 閉会挨拶 北陸先端科学技術大学院大学 寺野 稔 学長 ≪第2部:ライフサイエンス研究交流セミナー≫ ※対面限定 17:00~18:00 ポスターセッション・懇談会 ※ポスターセッションの詳細は追ってお知らせします(1月以降公開) |
| 参加申込 | 下記申込用フォームからお申込みください。≪事前登録必須≫ https://forms.office.com/pages/responsepage.aspx?id=0g6hxA4YVkSXJwaXjM06YImL-UB_gg5Hr98loCM5w1pURTQ1S0tXVFFLMlZXNTVGRkdJOVQxQUExUC4u&route=shorturl ※〆切:2025年2月2日(日)まで |
| 備 考 | ・会場での参加、オンライン参加ともに事前申込みが必要です。 ・オンライン参加の方には、登録されたメールアドレスへ後日Webexの接続情報をお送りします。 ・来客用駐車スペースの利用可。 |
| 本件 問合せ先 |
研究推進課 学術研究推進係 TEL:0761-51-1907 E-mail:suishin@ml.jaist.ac.jp |
物質化学フロンティア研究領域の都教授らの論文がSmall Science誌の表紙に採択
物質化学フロンティア研究領域の都 英次郎教授らの「がんを欺くためのがん細胞の顔をしたナノ粒子の開発に成功」に係る論文が、生物・化学系のトップジャーナルSmall Science誌の表紙に採択されました。なお、本研究は、文部科学省科研費 基盤研究(A)(23H00551)、文部科学省科研費 挑戦的研究(開拓)(22K18440)、国立研究開発法人科学技術振興機構(JST)研究成果最適展開支援プログラム (A-STEP)(JPMJTR22U1)、公益財団法人発酵研究所、公益財団法人上原記念生命科学財団、ならびに本学超越バイオメディカルDX研究拠点、本学生体機能・感覚研究センターの支援のもと行われたものです。
■掲載誌
Small Science, Vol. 4, No. 10
掲載日:2024年10月6日
■著者
Nina Sang, Yun Qi, Shun Nishimura, Eijiro Miyako*
■論文タイトル
Biomimetic Functional Nanocomplexes for Photothermal Cancer Chemoimmunotheranostics
■論文概要
本研究では、カーボンナノホーン表面にがん細胞成分と抗がん剤を被覆したナノ粒子の作製に成功しました。得られたナノ粒子は、ナノ粒子特有のEPR効果のみならず、がん細胞成分に由来する血中滞留性、腫瘍標的能によって、大腸がんを移植したマウス体内の腫瘍内に効果的に集積し、がん細胞成分に由来する免疫賦活化効果と抗がん剤に由来する薬効に加え、生体透過性の高い近赤外レーザー光により、がん患部の可視化と光熱変換による多次元的な治療が可能であることを実証しました。さらに、マウスを用いた生体適合性試験などを行い、いずれの検査からもナノ粒子が生体に与える影響は極めて少ないことがわかりました。当該ナノ粒子と近赤外レーザー光を組み合わせた新たながん診断・治療技術の創出が期待されます。
表紙詳細:https://onlinelibrary.wiley.com/doi/abs/10.1002/smsc.202470043
論文詳細:https://onlinelibrary.wiley.com/doi/10.1002/smsc.202400324
プレスリリース:https://www.jaist.ac.jp/whatsnew/press/2024/08/22-1.html
令和6年10月11日
出典:JAIST お知らせ https://www.jaist.ac.jp/whatsnew/info/2024/10/11-1.html夢のマイホームを細菌が手に入れたら・・・細菌の抗がん性能が劇的に向上することを発見

夢のマイホームを細菌が手に入れたら・・・
細菌の抗がん性能が劇的に向上することを発見
【ポイント】
- 水槽用ろ過材を使って細菌を培養すると細菌の薬剤耐性乳腺がんモデルマウスに対する抗がん活性と生体適合性が劇的に向上することを発見
- ろ過材に含まれる微量の光触媒(酸化チタン)が細菌の抗がん性能を高めることを発見
- 酸化チタンを内包した多孔質高分子複合材料を基材とするAUNの簡便な培養方法の樹立に成功
- 大動物を用いた安全性評価によってAUNの高い生体適合性を実証
| 北陸先端科学技術大学院大学(学長・寺野 稔、石川県能美市)物質化学フロンティア研究領域の都 英次郎教授と宮原 弥夏子大学院生(博士後期課程、JAIST SPRING研究員)らは、ろ過材を使って培養した細菌の薬剤耐性乳腺がんモデルマウスに対する抗がん活性と生体適合性が向上することを発見した。また、ろ過材に含まれる微量の光触媒(酸化チタン)が細菌の抗がん性能を高めるというメカニズムを見出したことで、酸化チタンを内包した多孔質高分子複合材料を基材とするAUNの簡便な培養方法の樹立に成功した。さらに、大動物を用いた安全性評価によってAUNの高い生体適合性を実証した。 |
【研究背景と内容】
人生で一番大きな買い物といえば、家を思い浮かべる方が多いだろう。もしこの夢のマイホーム(水槽用ろ過材)を細菌に与えてみると抗がん作用がどうなるのか、本研究は、そんな遊び心からスタートした。
アクアリウム愛好家の間では、金魚や熱帯魚の飼育における水槽内の水質浄化にろ過材を使用することが多い。ろ過材の役割とは、水質を汚染するアンモニアを分解する細菌の繁殖を助ける"住処(家)"を提供することであり、様々な形や種類のろ過材がペットショップ等で安価に入手することができる。なお、これまでろ過材を使用して培養した細菌を水質浄化以外の目的で利用されることは本研究を除いて未だかつて報告がない。
近年、低酸素状態の腫瘍内部で選択的に集積・生育・増殖が可能な細菌を利用したがん標的治療に注目が集まっている。都教授の研究グループは、腫瘍組織から強力な抗腫瘍作用のある複数の細菌[A-gyo(阿形)、UN-gyo(吽形)、AUN(阿吽)と命名]の単離に世界にさきがけて成功している[プレスリリース(阿吽の呼吸で癌を倒す!-灯台下暗し:最強の薬は腫瘍の中に隠されていた-)https://www.jaist.ac.jp/whatsnew/press/2023/05/08-1.html]。なかでもAUN(A-gyoとUN-gyoからなる複合細菌)は、様々ながん腫に対して高い抗腫瘍活性を示すことを見出している。将来の臨床試験を見据えて、当該複合細菌AUNの簡便な培養方法の構築が必要不可欠である。
本研究では、当該腫瘍内複合細菌AUNの抗がん性能を高めるべく、異なる表面構造を有する複数の多孔質ろ過材[セラミック、ガラス、麦飯石、ポリプロピレン(PP)]を使用した細菌培養を試みた。なお、AUNの培養には、構成細菌の一つであるUN-gyoが光合成細菌であるため、ハロゲンランプ等を用いる光照射が必須である。
各種ろ過材を用い、光照射下で培養したAUNを、薬剤耐性乳腺がん細胞株(EMT6/AR1)を背面に移植したマウスの尾静脈に投与したところ、セラミックス製ろ過材で培養したAUNが顕著な抗がん作用と有意なマウス生存率を示すことがわかった。一方、他のろ過材(麦飯石、ガラス、PP)で培養したAUNとろ過材を用いない従来のAUNでは、3日以内にマウスが死亡した。また、コントロール群(AUN未投与群)は経時的に明らかな腫瘍体積増加を示し、すべてのマウスが13日以内に死亡した。
材料表面上の材質や多孔質構造が、細菌の活動を含む細胞生理機能に影響を与えることがよく知られているものの、「いったい何故、セラミックス製ろ過材だけがAUNの抗がん作用や生体適合性を高めるのか」、本研究では、その謎の解明に迫った。
まず、4種類のろ過材の元素分析を行ったところ、無機材料で構成されるろ過材(セラミックス、麦飯石、ガラス)では、元素組成が良く似ており、主成分が二酸化ケイ素(SiO2)であることがわかった。一方、PP製のろ過材は91%割合のPPで構成されていた。また、セラミックス製のろ過材と麦飯石には、細菌やウイルスといった病原性微生物を排除するのによく利用される光触媒[酸化チタン(TiO2)]が微量に含まれていることがわかった。従って、「このTiO2がAUNの抗がん性能の向上に寄与しているのではないか」、という仮説を立てた。
本仮説を検証するために、TiO2を内包する多孔質のポリジメチルシロキサン(PDMS)(TiO2-PDMS)から成るろ過材を調製した。予想した通り、TiO2-PDMSろ過材を用いて培養したAUN(AUN@TiO2-PDMS)は、セラミックス製ろ過材を用いて培養したAUNと同様に単回投与で腫瘍が完全に消失した(図1A、1B)。比較対象として TiO2を含有していないPDMS 製の足場材料で培養した AUN では、2日以内にマウスが死亡することがわかった。一方、コントロール群(AUN未投与群)は腫瘍退縮や生存率の改善に全く効果が見られなかった。また、AUN@TiO2-PDMSの優れた抗がん作用により、マウスの生存率も有意に延長された(図1C)。以上の結果から、光触媒TiO2を内包した多孔質高分子複合材料によってAUNの抗がん性能を大幅に改善できることがわかった。
 図1.AUN@TiO2-PDMSの抗腫瘍効果に係る写真(腫瘍が完全消失)(A)、
図1.AUN@TiO2-PDMSの抗腫瘍効果に係る写真(腫瘍が完全消失)(A)、
腫瘍体積の経時変化(B)、ならびにマウス生存率(C)。
次に、何故、TiO2-PDMS複合材料がAUNの治療機能を向上できるのか、そのメカニズムを明らかにするために各種ろ過材でAUNを培養した後の細菌濃度を比較検証した(図2A)。この結果、TiO2-PDMSは、5日間培養した後のAUNの濃度を有意に減少させた。実際、TiO2を含有する3種類のろ過材(TiO2-PDMS、セラミックス製ろ過材、麦飯石)は、ハロゲンランプの光を3時間照射したところ細菌を弱体化させる効果のある活性酸素種(ROS)を検出した(図2B)。以上の結果をまとめると、光照射したTiO2-PDMS複合材料から発生するROSは、AUNの生体機能に影響を与えるため、毒性の低減化を引き起こしていると考えられる。
 図2. 各種ろ過材で培養した5日後の細菌濃度(A)と各種ろ過材から発生したROS(B)
図2. 各種ろ過材で培養した5日後の細菌濃度(A)と各種ろ過材から発生したROS(B)
次に、このようなAUNの高い抗腫瘍メカニズムを解析するために定量的ポリメラーゼ連鎖反応(qPCR)アッセイ、フローサイトメトリー解析、および免疫組織化学(IHC)染色を用いてAUN@TiO2-PDMSを静脈内投与した24時間後の固形腫瘍内の免疫細胞やサイトカインの挙動を調査した。この結果、AUN@TiO2-PDMSを投与すると腫瘍内の炎症性サイトカインTNF-αが増加し、T細胞、NK細胞、およびマクロファージが活性化されることが明らかになった(図3A、3B)。また、ヘマトキシリンとエオシン(H&E)染色では、非治療群と比較して、AUN@TiO2-PDMSの強力な抗がん効果による腫瘍組織の破壊も確認された(図3C)。さらに、AUN@TiO2-PDMS投与後の腫瘍切片におけるアポトーシスマーカー(カスパーゼ-3および末端デオキシヌクレオチジルトランスフェラーゼ[TdT]を介した2'-デオキシウリジン、5'-三リン酸[dUTP]ニックエンドラベリング[TUNEL])およびTNF-α染色により、腫瘍内では大規模なアポトーシスが発現しており、強い炎症反応が誘発されていることもわかった(図3C)。以上の結果より当該薬効メカニズムを図3Dにまとめる。最後に、大型動物モデル(ビーグル犬)を用いたAUN@TiO2-PDMSの安全性評価(血液学的、組織学的検査)を実施したところ、複合細菌AUN投与による重篤な副作用は無いことがわかった。
 図3. 免疫細胞と炎症系サイトカインの発現挙動に係るqPCRの結果(A)と
図3. 免疫細胞と炎症系サイトカインの発現挙動に係るqPCRの結果(A)と
フローサイトメトリーの結果(B)、ならびに組織学的染色の結果(C)。(D)薬効メカニズム。
本研究は、将来の悪性乳癌の臨床治療に向けて光触媒を内包したろ過材がAUNの機能増強のための有望な材料の一つに成り得ると期待している。
本成果は、2024年10月7日に生物・化学系のトップジャーナル「Chemical Engineering Journal」誌(エルゼビア社発行)のオンライン版に掲載された。なお、本研究は、文部科学省科研費 基盤研究(A)(23H00551)、文部科学省科研費 挑戦的研究(開拓)(22K18440)、国立研究開発法人科学技術振興機構(JST) 研究成果最適展開支援プログラム (A-STEP)(JPMJTR22U1)、JST次世代研究者挑戦的研究プログラム(未来創造イノベーション研究者支援プログラム)(JPMJSP2102)、公益財団法人発酵研究所、公益財団法人上原記念生命科学財団、ならびに本学超越バイオメディカルDX研究拠点、本学生体機能・感覚研究センターの支援のもと行われたものである。
【論文情報】
| 掲載誌 | Chemical Engineering Journal(エルゼビア社発行) |
| 論文題目 | Photocatalytic scaffolds enhance anticancer performances of bacterial consortium AUN |
| 著者 | Mikako Miyahara, Yuki Doi, Naoki Takaya, Eijiro Miyako* |
| 掲載日 | 2024年10月7日にオンライン版に掲載 |
| DOI | https://doi.org/10.1016/j.cej.2024.156378 |
令和6年10月9日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2024/10/09-1.html物質化学フロンティア研究領域の都准教授らの論文がJACS Au誌の表紙に採択

物質化学フロンティア研究領域の都 英次郎准教授らの「統合失調症の認知機能障害を回復する新薬候補- 脳移行性の皮下投与型ペプチドナノ製剤を開発 -」に係る論文が、アメリカ化学会発行の生物・化学系トップジャーナルJACS Au誌の表紙に採択されました。
なお、本研究は、文部科学省科研費 基盤研究(A)(23H00551)、基盤研究(B)(20H03392)、挑戦的研究(開拓)(22K18440)、国立研究開発法人科学技術振興機構(JST)研究成果最適展開支援プログラム(A-STEP)(JPMJTR22U1)、AMED橋渡し研究プログラム(JP22ym0126809)、創薬等先端技術支援基盤プラットフォーム(BINDS)(JP18am0101114、JP23ama121052、JP23ama121054)、公益財団法人発酵研究所、公益財団法人上原記念生命科学財団、ならびに本学超越バイオメディカルDX研究拠点、生体機能・感覚研究センター、広島大学トランスレーショナルリサーチセンターの支援などのもと行われたものです。
■掲載誌
JACS Au, Vol. 4, No. 8
掲載日:2024年8月26日
■著者
Kotaro Sakamoto*, Seigo Iwata, Zihao Jin, Lu Chen, Tatsunori Miyaoka, Mei Yamada, Kaiga Katahira, Rei Yokoyama, Ami Ono, Satoshi Asano, Kotaro Tanimoto, Rika Ishimura, Shinsaku Nakagawa, Takatsugu Hirokawa, Yukio Ago*, and Eijiro Miyako*
■論文タイトル
Cyclic Peptide KS-133 and KS-487 Multifunctionalized Nanoparticles Enable Efficient Brain Targeting for Treating Schizophrenia
■論文概要
統合失調症は、幻覚や妄想などの陽性症状、意欲の低下などの陰性症状、そして注意・集中力の低下や記憶力・判断力の低下といった認知機能障害などを特徴とする精神疾患で、人口の約1%に発症し、その罹患者は日本では約80万人、全世界では2000万人以上いると言われています。本研究では、統合失調症の発症に関係する神経ペプチド受容体VIPR2に対する選択的な阻害ペプチドKS-133と脳移行性のLRP1結合ペプチドKS-487を同時に搭載するナノ粒子を創製し、皮下投与型のペプチド製剤として開発に成功しました。また、本ペプチド製剤の皮下投与によって、VIPR2の過剰な活性化によって引き起こされた動物モデルの認知機能の低下を正常レベルまで回復可能なことを見出しました。本ペプチド製剤は、既存薬とは全く異なるメカニズムをもつため、統合失調症の新しい治療法の開発につながることが期待されます。
表紙詳細:https://pubs.acs.org/toc/jaaucr/4/8
論文詳細:https://pubs.acs.org/doi/10.1021/jacsau.4c00311
プレスリリース:https://www.jaist.ac.jp/whatsnew/press/2024/06/27-1.html
令和6年8月28日
出典:JAIST お知らせ https://www.jaist.ac.jp/whatsnew/info/2024/08/28-1.htmlがんを欺くためのがん細胞の顔をしたナノ粒子の開発に成功 -マウス体内のがんを高感度検出・効果的治療が可能に!-

がんを欺くためのがん細胞の顔をしたナノ粒子の開発に成功
-マウス体内のがんを高感度検出・効果的治療が可能に!-
【ポイント】
- カーボンナノホーンにがん細胞成分と抗がん剤を吸着させた複合体の作製に成功
- 当該ナノ粒子の高い血中滞留性、腫瘍内浸潤作用、EPR効果により腫瘍に集積し、マウスに移植したがんの可視化と、免疫賦活化作用、抗がん作用、光熱変換によるがん治療が可能であることを実証
- 当該ナノ粒子と近赤外光を組み合わせた新たながん診断・治療技術の創出に期待
| 北陸先端科学技術大学院大学(学長・寺野 稔、石川県能美市)物質化学フロンティア研究領域の都 英次郎准教授らは、カーボンナノホーン*1表面にがん細胞成分と抗がん剤を被覆したナノ粒子の作製に成功した(図1)。得られたナノ粒子は、ナノ粒子特有のEPR効果*2のみならず、がん細胞成分に由来する血中滞留性、腫瘍標的能によって、大腸がんを移植したマウス体内の腫瘍内に効果的に集積し、がん細胞成分に由来する免疫賦活化効果と抗がん剤に由来する薬効に加え、生体透過性の高い近赤外レーザー光*3により、がん患部の可視化と光熱変換による多次元的な治療が可能であることを実証した。さらに、マウスを用いた生体適合性試験などを行い、いずれの検査からもナノ粒子が生体に与える影響は極めて少ないことがわかった。当該ナノ粒子と近赤外レーザー光を組み合わせた新たながん診断・治療技術の創出が期待される。 |
【研究背景と内容】
ナノ炭素材料の一つであるカーボンナノホーン(CNH)は、高い生体適合性と優れた物理化学的特性を有することが知られており、とりわけバイオメディカル分野で大きな注目を集めている。都准教授は、CNHが生体透過性の高い波長領域(650~1100 nm)のレーザー光により容易に発熱する特性(光発熱特性)を世界に先駆けて発見し、当該光発熱特性を活用したがん診断・治療技術の開発を推進している[例えば、Nature Communications 11, 4117 (2020).]。
CNHは、そのまま水などに分散させようとすると、分子間の強い相互作用により、粒状に凝集してしまう。CNHの光発熱特性を発揮させるためには、この凝集状態を解消しCNHを溶媒中にナノレベルで分散させる必要がある。従来法としては、ポリエチレングリコール(PEG)などの水溶性ポリマーをCNH表面に化学的に被覆することで水中分散性を改善させる手法がある。しかし、PEG修飾したナノ粒子を繰り返し投与した際、2回目投与時において、従来の高い血中滞留性が損なわれ、血中から速やかに消失するという現象[Accelerated blood clearance(ABC)現象]が報告されているだけでなく、PEGそのものが重篤なアレルギー反応を引き起こす可能性があるため、代替材料の開発が急務となっている。
がん細胞は、免疫細胞からの攻撃回避のために特殊な細胞膜機能を有している。また、堅牢な腫瘍構造を維持するために、がん細胞同士の癒着・親和性を高めることが可能となる特別な細胞膜成分で構成されている。さらに、がん細胞内の構成成分(遺伝子やタンパク質など)には免疫活性を高める効果があることが知られている。そこで本研究グループは、これらのがん細胞成分(細胞膜、遺伝子、タンパク質など)をCNHに搭載することができれば、CNHのマウス体内における血中滞留性、腫瘍内浸潤性、免疫活性などを高めることができるのではないかと考え、研究をスタートさせた。より具体的には、がん細胞成分と抗がん剤を被覆したCNHをがん患部に同時に送り込むことで、がん細胞成分に由来する上記の血中滞留効果、腫瘍内浸潤作用、免疫賦活化能に加え、抗がん剤に由来する薬効と共に、生体透過性の高い近赤外レーザー光を用いることで、患部の可視化やCNHに由来する光熱変換を利用した、新たながんの診断や治療の実現を目指した。
当該目標を達成するために、今回開発した技術では、簡便な超音波照射によってがん細胞成分をCNH表面に吸着させることで、CNHを水溶液中に分散できるようにした。また、がん細胞成分を活用することで、水に不溶な抗がん剤[パクリタキセル(PTX)]もCNH表面に同時に被覆することに成功した(図1)。この方法で作製したがん細胞成分-PTX-CNH複合体は、30日以上の粒径安定性を有していること、細胞に対し高い膜浸透性を有し抗がん作用を発現すること、近赤外レーザー光照射により発熱が起こることが確認できたため、がん患部の可視化と治療効果について試験を行った。なお、がん患部の可視化には、がん診断に利用可能な近赤外蛍光色素[インドシアニングリーン(ICG)]をがん細胞成分と共にCNH表面に結合させたナノ粒子(がん細胞成分-ICG-CNH複合体)を利用した。
大腸がんを移植して約10日後のマウスに、当該がん細胞成分-ICG-PTX-CNH複合体を尾静脈から投与し、24時間後に740~790 nmの近赤外光を当てたところ、がん患部が蛍光を発している画像が得られた(図2A)。また、当該ナノ粒子が、非イオン性のポリエトキシ化界面活性剤(クレモフォールEL)で被覆した従来型の水溶性ポリマーで被覆したCNH(CRE-ICG-CNH複合体)に比較して、がん組織に効果的に取り込まれていることが分かった(図2A)。そこで、当該ナノ粒子(がん細胞成分-PTX-CNH複合体)が集積した患部に対して808 nmの近赤外レーザー光を照射したところ、がん細胞成分に由来する血中滞留効果、腫瘍内浸潤作用、免疫賦活化能と抗がん剤に由来する薬効に加え、CNHの光熱変換による効果で2日後には、がんを完全に消失させることに成功した(図2B)。
一方、腫瘍内における薬効メカニズムを組織学的評価により調査したところ、とりわけレーザー照射したがん細胞成分-PTX-CNH複合体において細胞障害性の高いT細胞やナチュラルキラー細胞などの免疫細胞が活性化されていることが明らかとなった。
さらに、がん細胞成分-PTX-CNH複合体をマウスの静脈から投与し、生体適合性を血液検査(1週間調査)と体重測定(約1ヵ月調査)により評価したが、いずれの項目でもがん細胞成分-PTX-CNH複合体が生体に与える影響は極めて少ないことがわかった。
これらの成果は、今回開発したがん細胞成分のナノ粒子コーティング技術が、革新的がん診断・治療法の基礎に成り得ることを示すだけでなく、ナノテクノロジーや光学といった幅広い研究領域における材料設計の技術基盤として貢献することを十分期待させるものである。
本成果は、2024年8月19日に生物・化学系のトップジャーナル「Small Science」誌(Wiley発行)のオンライン版に掲載された。なお、本研究は、文部科学省科研費 基盤研究(A)(23H00551)、文部科学省科研費 挑戦的研究(開拓)(22K18440)、国立研究開発法人科学技術振興機構(JST) 研究成果最適展開支援プログラム (A-STEP)(JPMJTR22U1)、公益財団法人発酵研究所、公益財団法人上原記念生命科学財団、ならびに本学超越バイオメディカルDX研究拠点、本学生体機能・感覚研究センターの支援のもと行われたものである。
 図1.がん細胞成分を被覆したナノ粒子の作製と本研究の概念。
図1.がん細胞成分を被覆したナノ粒子の作製と本研究の概念。
CNH: カーボンナノホーン、PTX: パクリタキセル。
 図2. ナノ粒子をがん患部に集積・可視化(A)し、光照射によりがんを治療(B)
図2. ナノ粒子をがん患部に集積・可視化(A)し、光照射によりがんを治療(B)
(赤色の囲いは腫瘍の位置を示している)。
【論文情報】
| 掲載誌 | Small Science |
| 論文題目 | Biomimetic functional nanocomplexes for photothermal cancer chemo-immunotheranostics |
| 著者 | Nina Sang, Yun Qi, Shun Nishimura, Eijiro Miyako* |
| 掲載日 | 2024年8月19日にオンライン版に掲載 |
| DOI | 10.1002/smsc.202400324 |
【用語説明】
飯島澄男博士らのグループが1998年に発見したカーボンナノチューブの一種。直径は2~5 nm、長さ40~50 nmで不規則な形状を持つ。数千本が寄り集まって直径100 nm程度の球形集合体を形成している。とりわけ、薬品の輸送用担体として期待されており、バイオメディカル分野で注目を集めている。
100 nm以下のサイズに粒径が制御された微粒子は、正常組織へは漏れ出さず、腫瘍血管からのみ、がん組織に到達して患部に集積させることが可能である。これをEPR効果(Enhanced Permeation and Retention Effect)という。
レーザーとは、光を増幅して放射するレーザー装置、またはその光のことである。レーザー光は指向性や収束性に優れており、発生する光の波長を一定に保つことができる。とくに700~1100 nmの近赤外領域の波長の光は生体透過性が高いことが知られている。
令和6年8月22日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2024/08/22-1.html物質化学フロンティア研究領域の都准教授らの論文がAdvanced Functional Materials誌の表紙に採択

物質化学フロンティア研究領域の都 英次郎准教授らの「液体金属ナノ粒子を活用するがん光免疫療法の開発に成功」に係る論文が、ドイツの生物・化学系トップジャーナルAdvanced Functional Materials誌の表紙に採択されました。
なお、本研究は、科研費基盤研究(A)(23H00551)、科研費挑戦的研究(開拓)(22K18440)、科学技術振興機構(JST)研究成果最適展開支援プログラム (A-STEP)(JPMJTR22U1)、公益財団法人発酵研究所、公益財団法人上原記念生命科学財団、ならびに本学超越バイオメディカルDX研究拠点、本学生体機能・感覚研究センターの支援のもと行われたものです。
■掲載誌
Advanced Functional Materials, Vol. 34, No. 31
掲載日:2024年8月1日
■著者
Yun Qi, Mikako Miyahara, Seigo Iwata, Eijiro Miyako*
■論文タイトル
Light-Activatable Liquid Metal Immunostimulants for Cancer Nanotheranostics
■論文概要
ガリウム・インジウム(Ga/In)合金からなる室温で液体の金属(液体金属)は、高い生体適合性と優れた物理化学的特性を有することが知られており、とりわけナノ粒子化した液体金属をバイオメディカル分野に応用する研究に大きな注目が集まっています。本研究では、液体金属ナノ粒子を活用した新しいがん光免疫療法の開発に取り組みました。より具体的には、免疫賦活化作用のある物質を液体金属に組み合わせ、がん患部に選択的に送り込ませることで、免疫による高い抗腫瘍作用を発現させることに成功しました。また、本研究では、生体透過性の高い近赤外光を用いることで、患部の可視化や光熱変換を利用した、新たながんの診断や治療法を提案しています。
表紙詳細:https://onlinelibrary.wiley.com/doi/10.1002/adfm.202470176
論文詳細:https://onlinelibrary.wiley.com/doi/10.1002/adfm.202305886
プレスリリース:https://www.jaist.ac.jp/whatsnew/press/2023/08/04-1.html
令和6年8月9日
出典:JAIST お知らせ https://www.jaist.ac.jp/whatsnew/info/2024/08/09-1.html統合失調症の認知機能障害を回復する新薬候補 -脳移行性の皮下投与型ペプチドナノ製剤を開発-

   |
| 国立大学法人 国立大学法人広島大学 国立大学法人大阪大学 国立大学法人筑波大学 一丸ファルコス株式会社 |
統合失調症の認知機能障害を回復する新薬候補
-脳移行性の皮下投与型ペプチドナノ製剤を開発-
【ポイント】
- 統合失調症の発症に関係する神経ペプチド受容体VIPR2に対する選択的な阻害ペプチドKS-133と脳移行性のLRP1結合ペプチドKS-487を同時に搭載するナノ粒子を創製し、 皮下投与型のペプチド製剤として開発
- 本ペプチド製剤の皮下投与は、VIPR2の過剰な活性化によって引き起こされた動物モデルの認知機能の低下を正常レベルまで回復可能
- 本ペプチド製剤は、既存薬とは全く異なるメカニズムをもつため、統合失調症の新しい治療法の開発につながることが期待
| 北陸先端科学技術大学院大学(学長・寺野稔、石川県能美市)物質化学フロンティア研究領域の都英次郎准教授、広島大学(学長・越智光夫、広島県広島市)大学院医系科学研究科の吾郷由希夫教授、大阪大学(総長・西尾章治郎、大阪府吹田市)大学院薬学研究科の中川晋作教授、筑波大学(学長・永田恭介、茨城県つくば市)医学医療系の広川貴次教授、一丸ファルコス株式会社(社長・安藤芳彦、岐阜県本巣市)の坂元孝太郎開発2課長らの研究グループは、統合失調症の認知機能障害を回復する新薬になり得る脳移行性の皮下投与型ペプチドナノ製剤の開発に成功した(図1)。 |
 図1. 本研究の概念図
図1. 本研究の概念図
統合失調症は、幻覚や妄想などの陽性症状、意欲の低下などの陰性症状、そして注意・集中力の低下や記憶力・判断力の低下といった認知機能障害などを特徴とする精神疾患で、人口の約1%に発症し、その罹患者は日本では約80万人、全世界では2000万人以上いると言われている。既存薬は、神経伝達物質の調節に関わるメカニズムを有するもののみであり、その治療効果は限定的であり、特に認知機能障害に対する効果が乏しい。近年、神経ペプチド受容体VIPR2の過剰な活性化が統合失調症の発症に関与することが臨床研究および非臨床研究で明らかとなり、新たなメカニズムの統合失調症治療薬につながることが期待されている。本研究グループは、これまでにVIPR2を選択的に阻害するペプチドKS-133を見出していたものの(FrontPharmacol 2021,12:751587)、脳への移行性が低いことが課題であった。
本研究では、KS-133を脳に送り届けるためのナノ製剤化を検討した。血液脳関門に発現するLDL受容体関連タンパク質のLRP1は、物質を血中から脳組織に移行させる働きがある。本研究グループは、これまでにLRP1に結合するペプチドKS-487を見出していた(Biochem Biophys Rep 2022,32:101367)。そこで、1.LRP1とKS-487の複合体の構造解析を分子動力学シミュレーションで実施、2.その構造を元にKS-487を表面に提示するナノ粒子をデザイン、3.バイオイメージング試験で皮下投与されたKS-487提示ナノ粒子が脳に移行することを確認、4.KS-487提示ナノ粒子にKS-133を内包させたペプチド製剤を調製し、その効果を動物モデルで確認した。これらの結果、KS-133とKS-487を同時に搭載するナノ粒子が、KS-133を脳に効果的に移行させ、動物モデルの認知機能障害を健常レベルまで回復させることが分かった(図2)。

図2. 統合失調症モデルマウスでの認知機能を評価する試験。マウスは新しい環境や物体を積極的に探索する習性をもつ。マウスに二つの新しい物体AとBを探索させて、記憶させる。24時間後に既知物体であるBを新しい物体Cに置き換えて、マウスが物体Cをどれだけ探索するかを計測することで、マウスの物体認知、学習・記憶能力を解析する。物体AとCの総探索時間のうち、どれだけ物体Cを探索していたかを調べる識別指数を用いて評価する。数値が高いほど認知機能が高いことを意味する。統合失調症モデルマウスの識別指数は、VIPR2選択的阻害ペプチドKS-133を内包し、中枢移行性ペプチドKS-487を提示するナノ粒子の投与によって、正常マウスと同等レベルに回復する。
本研究成果は、アメリカ化学会発行の生物・化学系のトップジャーナル「JACS Au」(アメリカ化学会発行)のオンライン版に2024年6月20日に掲載された。なお、本研究は、文部科学省科研費 基盤研究(A)(23H00551)、基盤研究(B)(20H03392)、挑戦的研究(開拓)(22K18440)、国立研究開発法人科学技術振興機構(JST)研究成果最適展開支援プログラム(A-STEP)(JPMJTR22U1)、AMED橋渡し研究プログラム(JP22ym0126809)、創薬等先端技術支援基盤プラットフォーム(BINDS)(JP18am0101114、JP23ama121052、JP23ama121054)、公益財団法人発酵研究所、公益財団法人上原記念生命科学財団、ならびに北陸先端科学技術大学院大学超越バイオメディカルDX研究拠点、生体機能・感覚研究センター、広島大学トランスレーショナルリサーチセンターの支援などのもと行われたものである。
【今後の展開】
本ペプチド製剤は、VIPR2阻害という既存薬とは全く異なるメカニズムを有しており、アンメットメディカルニーズである統合失調症の認知機能障害を対象とした新薬になることが期待される。今後、細胞や動物モデルなどを用いた更なる検討、そしてヒトでの臨床試験によって、本ペプチド製剤の有効性と安全性を確認し、統合失調症の新しい治療薬として開発を進めていく。
【論文情報】
| 掲載誌 | JACS Au (アメリカ化学会誌) |
| 論文題目 | Cyclic Peptide KS-133 and KS-487 Multifunctionalized Nanoparticles Enable Efficient Brain Targeting for Treating Schizophrenia |
| 著者 | Kotaro Sakamoto*, Seigo Iwata, Zihao Jin, Lu Chen, Tatsunori Miyaoka, Mei Yamada, Kaiga Katahira, Rei Yokoyama, Ami Ono, Satoshi Asano, Kotaro Tanimoto, Rika Ishimura, Shinsaku Nakagawa, Takatsugu Hirokawa, Yukio Ago*, and Eijiro Miyako* |
| 掲載日 | 2024年6月20日 |
| DOI | https://doi.org/10.1021/jacsau.4c00311 |
令和6年6月27日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2024/06/27-1.htmlがん治療のための多機能性アミノ酸ナノ粒子の開発に成功

  |
国立大学法人 フランス国立科学研究センター |
がん治療のための多機能性アミノ酸ナノ粒子の開発に成功
【ポイント】
- 3種類のペプチドと光開始剤が溶解した水溶液に紫外線を照射すると球状のナノ粒子が生成することを発見
- 合成したアミノ酸ナノ粒子に抗がん剤が封入可能であり、タンニン酸-鉄複合体をナノ粒子表面にコーティングできることを発見
- 多機能性アミノ酸ナノ粒子の複合的な分子設計によって生体内外の効果的ながん細胞死を誘導することに成功
北陸先端科学技術大学院大学(学長・寺野稔、石川県能美市)物質化学フロンティア研究領域の都英次郎准教授らはフランス国立科学研究センター(所長・アントワーヌ・プチ、フランス・パリ)のアルベルト・ビアンコ博士ら(同センター細胞分子生物学研究所、フランス・ストラスブール)と共同で、多機能性のアミノ酸*1から構成されるナノ粒子を活用した新しいがん治療技術の開発に成功した(図1)。
ペプチドやタンパク質の構成要素であるアミノ酸は、高い生体適合性を有するため、とりわけナノ粒子化したアミノ酸をバイオメディカル分野に応用する研究に大きな注目が集まっている。都准教授の研究チームでも、光を使った簡便な手法によりアミノ酸ナノ粒子を合成できれば、新しいがん治療技術が実現できるのではないかと考え、研究をスタートさせた。
研究チームは、N末端*2を9-フルオレニルメチルオキシカルボニル基(Fmoc)*3で保護した3種類のペプチド*4(Fmoc保護トリプトファン- Fmoc保護トリプトファン、Fmoc保護チロシン-Fmoc保護トリプトファン、Fmoc保護チロシン- Fmoc保護チロシン)と光開始剤(リボフラビン*5)が溶解した水溶液に紫外線*6を照射するとアミノ酸分子間における共有結合*7を介した光架橋*8と非共有結合*9を介した自己組織化現象*10が誘起され、約100 nmの直径の球状ナノ粒子が形成されることを見出した(図1)。また、合成したアミノ酸ナノ粒子は、抗がん剤(ドキソルビシン*11)が容易に封入可能であり、生体透過性の高い近赤外レーザー*12に応答して発熱するタンニン酸-鉄複合体*13をナノ粒子表面にコーティングできることも明らかとなった。さらに、研究チームは、細胞やマウスを用いた実験によって、これらの複合的な分子設計に基づいた多機能性アミノ酸ナノ粒子が効果的ながん光治療技術に応用可能であることを示した。
本成果は、2023年12月28日にWiley-VCH発行「Small」のオンライン版に掲載された。なお、本研究は、文部科学省科研費 基盤研究(A)(23H00551)、文部科学省科研費 挑戦的研究(開拓)(22K18440)、国立研究開発法人科学技術振興機構(JST) 研究成果最適展開支援プログラム (A-STEP)(JPMJTR22U1)、公益財団法人発酵研究所、公益財団法人上原記念生命科学財団、ならびに本学超越バイオメディカルDX研究拠点、本学生体機能・感覚研究センターの支援のもと行われたものである。
 図1. 多機能性アミノ酸ナノ粒子の構造
図1. 多機能性アミノ酸ナノ粒子の構造
【論文情報】
| 掲載誌 | Small (Wiley-VCH) |
| 論文題目 | Photocrosslinked co-assembled amino acid nanoparticles for controlled chemo/photothermal combined anticancer therapy |
| 著者 | Tengfei Wang, Yun Qi, Eijiro Miyako,* Alberto Bianco,* Cécilia Ménard-Moyon* |
| 掲載日 | 2023年12月28日にオンライン版に掲載 |
| DOI | 10.1002/smll.202307337 |
【用語説明】
アミノ基(-NH2)とカルボキシ基(-COOH)の両方を持つ有機化合物の総称。天然には約500種類のアミノ酸が見つかっており、そのうち22種類が、鎖状に多数連結(重合)して高分子を形成しタンパク質となる。ヒトのタンパク質は約20種類のアミノ酸から構成されている。
タンパク質またはペプチドにおいてフリーなアミノ基で終端している側の末端のこと。
有機合成で用いられる、アミノ基の保護基の1つ。Fmoc(エフモック)基と略される。
アミノ酸が結合したもの。アミノ酸とアミノ酸がペプチド結合(-CONH-)して、2個以上つながった構造のものをペプチドという。
光開始剤とは主に可視光や紫外光を吸収し、この光エネルギーをフリーラジカルに変換する化学物質のこと。リボフラビンは、紫外線の存在下、光還元反応によりフリーラジカルを生成する。この性質を利用して、分子間の架橋が可能となり、光開始剤として合成反応によく利用される。
波長が可視光よりも短い10nm~400nmの光。
原子同士の間で電子を共有することで生じる化学結合で、結合力が強い。
光で化学結合を形成することにより、分子中の特定原子間にできる三次元的な化学結合のこと。
共有結合以外の原子同士を結びつける力を表し、水素結合やπ-π(パイ-パイ)相互作用などが知られている。共有結合に比べて結合力は弱いが、複数の力が協同的に働くことで原子・分子はあたかも共有結合のように連結される。
分子や原子などの物質が自発的に秩序を持つ大きな構造を作り出す現象。
抗ガン剤の一種である。腫瘍細胞の核内の遺伝子に結合することで、DNAやRNAを合成する酵素の働きを阻害することで抗腫瘍効果を示す。
レーザーとは、光を増幅して放射するレーザー装置、またはその光のことである。レーザー光は指向性や収束性に優れており、発生する光の波長を一定に保つことができる。とくに700~1100 nmの近赤外領域の波長の光は生体透過性が高いことが知られている。
タンニン酸はタンパク質を変性させることにより組織や血管を縮める作用を有する渋味を示す化学物質。鉄イオンと反応し強く結合して難溶性の塩(タンニン酸-鉄複合体)を形成することが知られている。
令和6年1月9日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2024/01/09-1.html


