研究活動の検索
研究概要(研究室ガイド)やプレスリリース・受賞・イベント情報など、マテリアルサイエンスの研究室により公開された情報の中から、興味のある情報をタグや検索機能を使って探すことができます。糖鎖による抗体ダイナミクスの制御機構を解明 ~分子経絡が抗体医薬設計の新たな鍵に~
  |
| 大学共同利用機関法人 国立大学法人 東京科学大学 公立大学法人 名古屋市立大学 ⼀般財団法人 国立大学法人 大阪大学 国立大学法人 |
糖鎖による抗体ダイナミクスの制御機構を解明
~分子経絡が抗体医薬設計の新たな鍵に~
自然科学研究機構(生命創成探究センター)の谷中冴子 准教授(現 東京科学大学 准教授)、加藤晃⼀ 教授(生命創成探究センター、名古屋市立大学)らは、抗体の糖鎖修飾、特にガラクトース付加が、抗体分子の構造と動態に及ぼす影響を原子レベルで解明しました。
本研究の成果は、国際科学雑誌 「Proceedings of the National Academy of Sciences of the United States of America(米国科学アカデミー紀要)」に掲載予定です。論文は日本時間2025年8月5日の週にオンライン公開される予定であり、DOIおよび掲載URLは公開後に付与されます。
【発表のポイント】
私たちの体には、病原体から身を守るための免疫システムが備わっています。その中心的な役割を担うのが「免疫グロブリンG(IgG)」注1) と呼ばれる抗体です。IgGは、特定の抗原を認識して結合するだけでなく、Fc受容体や補体といったエフェクター分子との相互作用を通じて、様々な免疫応答を誘導します。本研究では、IgGのFc領域 注2) に結合した「糖鎖」の修飾が、IgGの動的な構造変化を制御し、その結果として免疫機能が調節されるメカニズムを、計算科学と実験科学を融合したアプローチで明らかにしました。特に、本研究では、糖鎖修飾による影響が、あたかも私達の体の中に張り巡らされた経絡のように、分子レベルで伝播していく「分子経絡」注3) の重要性に着目しました。
【研究の背景】
治療用抗体は、がんや自⼰免疫疾患など、さまざまな疾患の治療に用いられています。抗体の効果は、標的抗原への結合だけでなく、Fc領域を介したエフェクター機能 注4) の発揮によっても大きく左右されます。Fc領域の糖鎖修飾 注5) は、抗体のエフェクター機能を調節する重要な因子であり、そのメカニズム解明は、より効果的な抗体医薬品の開発につながると考えられています。
【本研究の手法と成果】
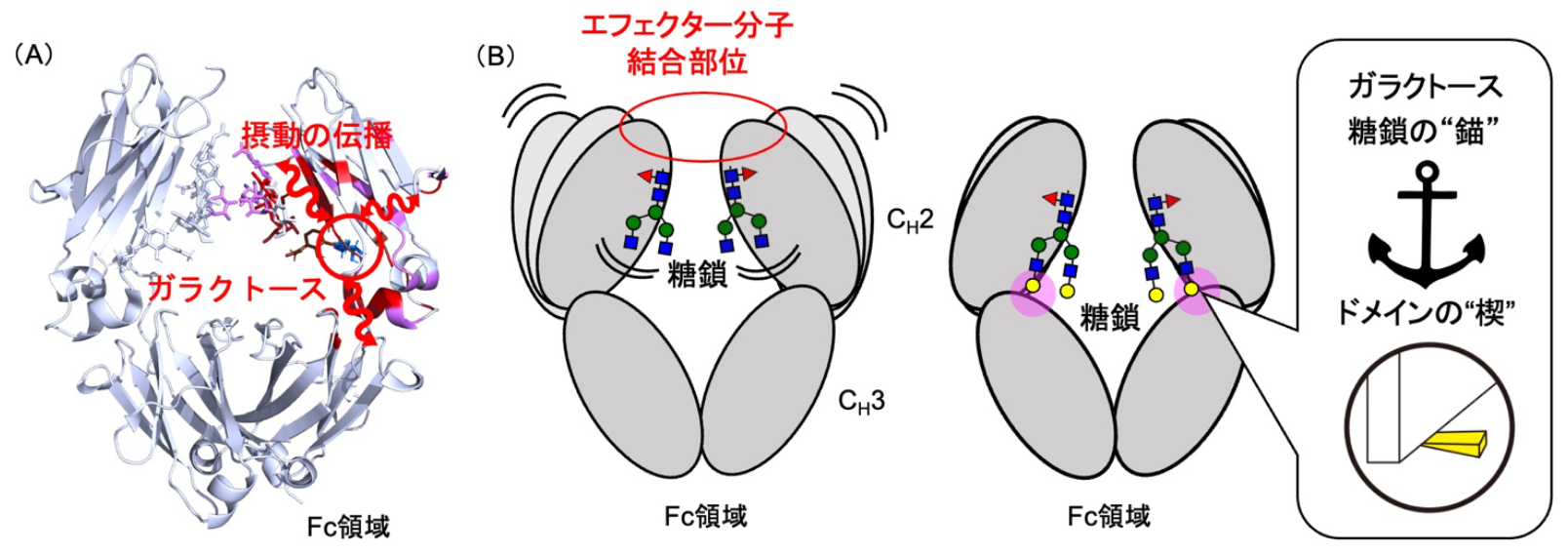
研究グループは、遺伝子工学的手法と酵素反応を組み合わせることで、糖鎖構造が異なるIgG1-Fcを調製しました。これらについて、安定同位体標識NMR分光法 注6) を用いてFc領域の動的構造を解析するとともに、分子動力学シミュレーション 注7) によって糖鎖修飾がFc領域のコンフォメーション変化に与える影響を評価しました。また、動的ネットワーク解析を用いて、「分子経絡」を同定しました。NMR分光法と分子動力学シミュレーションの結果から、ガラクトース 注8) 残基は糖鎖の動きを止める「錨」およびFc領域全体の動きを抑える「楔」としてはたらき、フコース 注9) 除去は特定のFc受容体との結合に関与するアミノ酸残基の動態を変化させることが明らかになりました。これらの結果は、糖鎖修飾がIgGのFc領域の動的構造を制御し、エフェクター機能を調節するメカニズムを原子レベルで理解する上で重要な知見となります。特に、「分子経絡」の存在は、糖鎖修飾の効果がFc領域全体に伝播する様子を示唆しています。

| (図)(A)糖鎖のガラクトース残基での構造変化がFc分子内を伝わる様子を示している。(B)ガラクトース残基は糖鎖(黄色の丸)の動きを止める「錨」およびFc領域全体の動きを抑える「楔」としてはたらき、エフェクター分子との相互作用を助けている。 |
【成果の意義および今後の展開】
本研究成果は、治療用抗体の開発において、Fc領域の糖鎖修飾を最適化するための合理的な設計基盤を提供します。今後は、糖鎖修飾と抗体の構造・機能相関に関するさらなる研究を進めることで、また「分子経絡」の操作という新たな視点を取り入れることで、より効果的かつ安全な抗体医薬品の開発に貢献できると期待されます。
【用語解説】
【論文情報】
| 掲載誌 | Proceedings of the National Academy of Sciences of the United States of America |
| タイトル | Exploring Glycoform-Dependent Dynamic Modulations in Human Immunoglobulin G via Computational and Experimental Approaches |
| 著者 | Saeko Yanaka, Yoshitake Sakae, Yohei Miyanoiri, Takumi Yamaguchi, Yukiko Isono, Sachiko Kondo, Miyuki Iwasaki, Masayoshi Onitsuka, Hirokazu Yagi, Koichi Kato*(*責任著者) |
| DOI | |
| 掲載日 |
【著者情報】
東京科学大学 総合研究院 フロンティア材料研究所)
名古屋市立大学大学院薬学研究科)
【研究サポート】
本研究は、文部科学省科学研究費助成事業(JP20K15981 および JP23K24018 谷中冴子、JP19H01017 および JP24H00599 加藤晃⼀)、日本医療研究開発機構(AMED)(JP21ae0121020 および JP23ak0101209 谷中冴子、JP21ae0121013 加藤晃⼀)、文部科学省研究大学総合研究育成事業:研 究大学強化促進事業(CURE)課題番号JPMXP1323015488(Spin-LプログラムNo. spin24XN014)、生命創成探究センター共同利用研究(24EXC901、25EXC603)、および科学技術振興機構(JST)戦略的 創造研究推進事業(CREST)(JPMJCR21E3 加藤晃⼀)の助成を受けたものです。また、本研究は文部 科学省ナノテクノロジープラットフォーム事業(分子・物質合成)、大阪大学蛋白質研究所共同利用・共 同研究拠点 NMRCR-16-05, 17-05, 18-05, 19-05, 20-05, 21-05、計算科学研究センター(24-IMS-C197)、文部科学省先端研究設備共用促進事業(コアファシリティ構築支援プログラム)JPMXS0441500024、国際・産学連携インヴァースイノベーション材料創出(DEJI2MA)プロジェクト、およびヒューマングライコームプロジェクトの支援を受けて行われました。
令和7年8月5日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2025/08/05-1.html学生のXUさんがEM-NANO 2025においてStudent Awardを受賞
学生のXU, Yuanzheさん(博士後期課程3年、ナノマテリアル・デバイス研究領域、大島研究室)が、The 10th International Symposium on Organic and Inorganic Electronic Materials and Related Nanotechnologies(EM-NANO 2025)において、Student Awardを受賞しました。
EM-NANO 2025は、有機・無機エレクトロニクス材料とナノテクノロジーに関する国際シンポジウムで、令和7年6月11日~14日にかけて、福井県福井市のAOSSA(福井県県民ホール)にて開催されました。
同シンポジウムでは、全体講演(Plenary lectures)や招待講演、特別セッションのほか、開催10回目を記念する式典も行われ、エレクトロニクス分野における最新の研究成果について活発な議論が行われました。
※参考:EM-NANO 2025
■受賞年月日
令和7年6月14日
■研究題目、論文タイトル等
Microscopic study of Kanazawa gold leaves
■研究者、著者
Yuanzhe Xu, Satoshi Ichikawa (大阪大学) , Kohei Aso, Hideyuki Murata, Yoshifumi Oshima
■受賞対象となった研究の内容
超薄膜(約100~200 nm)である金沢金箔の組織変化を調査しました。常温で処理されたにもかかわらず、焼鈍や熱間圧延を行わなくても、面心立方(FCC)金属において強い{001}テクスチャが形成されることは、長年の謎でした。今回、EBSDとTEMを用いて、No. 4金箔において[101]方向に沿って幅約100nmのスリップバンドが形成され、{011}-<011>スリップシステムと一致することを発見しました。この滑り系はFCC金属では稀な現象であり、超薄膜による活性化が原因と考えられます。この現象と交差滑り活動が、ハンマー加工中の{001}組織の形成を促進しています。
■受賞にあたって一言
It is a great honor to receive the "Student Award" at EM-NANO2025. I am truly encouraged by this recognition from the committee, which strengthens my determination to further explore the unique deformation mechanisms of Kanazawa gold leaf. As this research is closely tied to the cultural and scientific heritage of Kanazawa and the Hokuriku region, receiving this award at a local conference is especially meaningful to me. This achievement would not have been possible without the invaluable support and guidance of my supervisor, Prof. Yoshifumi Oshima, and the generous assistance of Specially Appointed Professor Satoshi Ichikawa from the Research Center for Ultra-High Voltage Electron Microscopy, Osaka University. I would also like to thank Senior Lecturer Kohei Aso and all the laboratory members for their generous support in both research and daily life.
令和7年7月17日
出典:JAIST 受賞https://www.jaist.ac.jp/whatsnew/award/2025/07/17-2.htmlナノ医療・バイオイメージング分野における国際連携を加速 ―ハーバード大教授が北陸先端科学技術大学院大学に本格参画-

ナノ医療・バイオイメージング分野における国際連携を加速
―ハーバード大教授が北陸先端科学技術大学院大学に本格参画-
北陸先端科学技術大学院大学(学長・寺野稔、石川県能美市)は、2025年4月1日付で、ナノ医療・バイオイメージング分野における世界的な研究者であるChoi, Hak Soo(チェ・ハクスー)教授を、先端科学技術研究科のクロスアポイントメント教員として迎え、本学での研究活動を開始しました。
Choi教授は、ハーバード大学医学部 放射線腫瘍学講座の教授であり、マサチューセッツ総合病院 分子イメージング研究センターの主任研究者として最前線の研究を統括するとともに、Dana-Farber/Harvard Cancer Centerにも所属し、がん研究と診断に関する世界的ネットワークの中核的存在として活躍しています。
韓国・全北大学校を卒業後、2004年に本学にて博士号(材料科学)を取得。その後、ハーバード大学にて研究を推進し、ナノメディシン、イメージング、バイオエンジニアリングを融合したがんの高感度診断・治療技術の開発に取り組んできました。これまでに、Nature Biotechnology、Nature Nanotechnology、Nature Medicine、Nature Communications、Advanced Materials、Science Translational Medicine などの国際トップジャーナルに多数の研究成果が掲載されており、米国国立衛生研究所(NIH)や国防総省(DoD)などからの大型研究助成を獲得しています。
今回の着任は、本学物質化学フロンティア研究領域の栗澤元一教授との長年にわたる共同研究を背景に実現したものであり、今後は、本学の「超越バイオメディカルDX研究拠点」との連携を軸に、研究成果の社会実装、若手研究者や学生との国際交流を通じて、グローバルトップの研究基盤の構築・強化に大きく貢献することが期待されています。
【セミナーのご案内】
このたび、Choi教授の本学参画を記念し、以下のとおり「超越バイオメディカルDX研究拠点エクセレントコアセミナー」を開催します。当日は、Choi教授より、これまでの研究成果および今後の取組みについて講演いただきます。つきましては、当日の取材・報道をお願いします。
|
講 演 者:CHOI, Hak Soo, Ph.D
北陸先端科学技術大学院大学 先端科学技術研究科 教授 Professor, Department of Radiology, Harvard Medical School Faculty, Cancer Research Institute, Dana-Farber/Harvard Cancer Center Director, Bioengineering and Nanomedicine Program, Mass General Hospital テーマ:「Bioengineering and Nanomedicine Program for Cancer Theranostics」
(バイオ工学とナノメディシンによるがんセラノスティックス*) 日 時:令和7年6月3日(火)10:30~12:00
場 所:北陸先端科学技術大学院大学(JAIST) イノベーションプラザ2F
シェアードオープンイノベーションルーム 申込方法:以下申込先までメールにて事前にお申込みください。
[申込先] 北陸先端科学技術大学院大学 超越バイオメディカルDX研究拠点 教授 栗澤元一 E-mail:kurisawa |
*セラノスティックス...診断と治療を一体化した新しい医療技術
◆クロスアポイントメント制度とは】
研究者等が複数の大学や公的研究機関、民間企業等と雇用契約を結び、それぞれの組織で業務を行うことを可能とする制度です。本制度により、研究者等は所属の枠にとらわれることなく、複数の場で専門性を活かして活躍できるようになります。本制度の導入により、研究機関間の垣根を超えた知の交流や技術の橋渡しが加速されることが期待されており、研究の質やスピードの向上にも大きく貢献すると考えられます。
今回、本学が本制度を通じて、海外の研究機関に所属する研究者を迎えたことは、本学にとって初の取り組みです。今後は、この制度を活用して、国内外の優れた研究者とのネットワークを一層広げ、世界の先端科学技術研究のハブとしての機能強化を目指します。
令和7年5月29日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2025/05/29-1.html細菌成分をコーティングした酸化グラフェンナノ複合体の創出! -多機能性を発現可能ながん光免疫療法の実現に向けて-

細菌成分をコーティングした酸化グラフェンナノ複合体の創出!
-多機能性を発現可能ながん光免疫療法の実現に向けて-
【ポイント】
- 細菌成分と酸化グラフェンから成るナノ複合体の作製に成功
- 当該ナノ複合体のEPR効果により標的とする腫瘍内に効果的に集積し、マウスに移植したがんの可視化と、免疫賦活化、抗がん作用、光熱変換によるがん治療が可能であることを実証
- 当該ナノ粒子と近赤外光を組み合わせた新たながん診断・治療技術の創出に期待
| 北陸先端科学技術大学院大学(学長・寺野 稔、石川県能美市)物質化学フロンティア研究領域の都 英次郎教授らは、酸化グラフェン*1表面に細菌成分、近赤外蛍光色素(インドシアニングリーン*2)、抗がん剤(カンプトテシン*3)を被覆したナノ複合体の作製に成功した(図1)。得られたナノ複合体は、ナノ複合体特有のEPR効果*4に由来する腫瘍標的能によって、大腸がんを移植したマウス体内の腫瘍内に効果的に集積し、細菌成分による免疫賦活化とカンプトテシンに由来する抗がん作用に加え、生体透過性の高い近赤外レーザー光*5により、インドシアニングリーンに由来するがん患部の可視化と酸化グラフェンに由来する光熱変換による多次元的な治療が可能であることを実証した。さらに、マウスを用いた生体適合性試験などを行い、いずれの検査からもナノ複合体が生体に与える影響は極めて少ないことがわかった。当該ナノ複合体と近赤外レーザー光を組み合わせた新たながん光免疫治療技術の創出が期待される。 |
【研究背景と内容】
ナノ炭素材料の一つである酸化グラフェン(GO)は、優れた物理化学的特性を有することが知られており、とりわけ素材開発の分野で注目を集めている。都教授は、ナノ炭素材料が生体透過性の高い波長領域(650~1100 nm)のレーザー光により容易に発熱する特性(光発熱特性)を活用したがん診断・治療技術の開発を推進している(※1、※2、※3、※4)。
(※1) https://www.jaist.ac.jp/whatsnew/press/2020/04/23-1.html
(※2) https://www.jaist.ac.jp/whatsnew/press/2020/08/17_2.html
(※3) https://www.jaist.ac.jp/whatsnew/press/2024/08/22-1.html
(※4) https://www.jaist.ac.jp/whatsnew/press/2025/03/06-1.html
一方、腫瘍組織内に細菌が存在していることは古くから知られており、近年の研究では、腫瘍の種類ごとに独自の細菌叢が保有されていることが分かっている。また、このような腫瘍内細菌叢が抗癌剤の補助あるいは阻害の要因になっていることも明らかになっている。しかし、腫瘍内から直接細菌を取り出し、細菌そのものを癌の治療薬として活用する研究は皆無であった。このような経緯の中、都研究室では、マウス生体内の腫瘍組織から数多くの細菌の単離・同定に成功しており、これらの細菌を活用したがん診断・治療技術の開発を進めている(※5)。
(※5) https://www.jaist.ac.jp/whatsnew/press/2023/05/08-1.html
本研究では、光発熱素材であるGOと超音波照射によりホモジナイズ*6した腫瘍内細菌(Cutibacterium acnes)成分を複合化した新規ナノ複合体を開発し、がん診断・治療技術への可能性を調査した(図1)。より具体的には、C. acnes(CA)成分、近赤外蛍光色素[インドシアニングリーン(ICG)]、抗がん剤[カンプトテシン(CPT)]を被覆したGO(ICG-CPT-CA-GO複合体)をがん患部に同時に送り込むことで、CAに由来する免疫賦活化作用とCPTに由来する抗がん作用に加え、生体透過性の高い近赤外レーザー光を用いることで、ICGに由来する近赤外蛍光特性を用いた患部の可視化やGOに由来する光熱変換を利用した、新たながんの診断や治療法の開発に成功した。また、ICG-CPT-CA-GO複合体をマウスの静脈から投与し、生体適合性を組織学的検査、血液検査、体重測定により評価したが、いずれの項目でもICG-CPT-CA-GO複合体が生体に与える影響は極めて少ないことがわかった。
これらの成果は、今回開発したICG-CPT-CA-GO複合体が、革新的がん診断・治療法の基礎に成り得ることを示すだけでなく、ナノテクノロジーや光学といった幅広い研究領域における材料設計の技術基盤として貢献することを十分期待させるものである。
本成果は、2025年3月21日に炭素系材料の国際専門トップジャーナル「Carbon」誌(Elsevier発行)のオンライン版に掲載された。なお、本研究は、文部科学省科研費 基盤研究(A)(23H00551)、文部科学省科研費 挑戦的研究(開拓)(22K18440)、国立研究開発法人科学技術振興機構(JST) 研究成果最適展開支援プログラム (A-STEP)(JPMJTR22U1)、大学発新産業創出基金事業スタートアップ・エコシステム共創プログラム(JPMJSF2318)ならびに本学超越バイオメディカルDX研究拠点、本学生体機能・感覚研究センターの支援のもと行われたものである。
 図1. 様々な機能性分子を被覆したナノ複合体の作製(超音波処理するだけで簡便に作製可能)。
図1. 様々な機能性分子を被覆したナノ複合体の作製(超音波処理するだけで簡便に作製可能)。
【論文情報】
| 掲載誌 | Carbon |
| 論文題目 | Hybrid Nanoarchitectonics with Bacterial Component-Integrated Graphene Oxide for Cancer Photothermo-Chemo-Immunotherapy |
| 著者 | Soudamini Sai Vimala Veera Chintalapati, Eijiro Miyako* |
| 掲載日 | 2025年3月21日にオンライン版に掲載 |
| DOI | 10.1016/j.carbon.2025.120252 |
【用語説明】
酸化グラフェンとは、黒鉛を酸化させることにより得られ、厚さはおよそ 1 nmのシート状の素材。高い表面積を有し、表面に存在する酸素官能基により親水性や電気絶縁性を示す。
肝機能検査に用いられる緑色色素のこと。近赤外レーザー光を照射すると近赤外蛍光と熱を発することができる。
植物のカンレンボク Camptotheca acuminata に含まれるアルカロイドの一種。抗がん作用を示す。
100nm以下のサイズに粒径が制御された微粒子は、正常組織へは漏れ出さず、腫瘍血管からのみ、がん組織に到達して患部に集積させることが可能である。これをEPR効果(Enhanced Permeation and Retention Effect)という。
レーザーとは、光を増幅して放射するレーザー装置、またはその光のことである。レーザー光は指向性や収束性に優れており、発生する光の波長を一定に保つことができる。とくに700~1100 nmの近赤外領域の波長の光は生体透過性が高いことが知られている。
均質化すること。特に、生物の細胞や組織などを人工的に破砕、均質化することをさす。眼鏡の洗浄に利用される超音波照射装置が均質化に良く利用される。
令和7年3月27日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2025/03/27-1.html磁石と光で機能制御可能なナノ粒子の開発に成功! -高性能がん診断・治療に向けて-

磁石と光で機能制御可能なナノ粒子の開発に成功!
-高性能がん診断・治療に向けて-
【ポイント】
- 磁性イオン液体とカーボンナノホーンから成る複合体の作製に成功
- 当該ナノ粒子の磁場応答性とEPR効果により標的とする腫瘍内に効果的に集積し、マウスに移植したがんの可視化と、抗がん作用、光熱変換によるがん治療が可能であることを実証
- 当該ナノ粒子と近赤外光を組み合わせた新たながん診断・治療技術の創出に期待
| 北陸先端科学技術大学院大学(学長・寺野 稔、石川県能美市)物質化学フロンティア研究領域の都 英次郎教授らは、カーボンナノホーン*1表面に磁性イオン液体*2、近赤外蛍光色素(インドシアニングリーン*3)、分散剤(ポリエチレングリコール-リン脂質複合体*4)を被覆したナノ粒子の作製に成功した(図1)。得られたナノ粒子は、ナノ粒子特有のEPR効果*5のみならず、磁性イオン液体に由来する磁場駆動の腫瘍標的能によって、大腸がんを移植したマウス体内の腫瘍内に効果的に集積し、磁性イオン液体に由来する抗がん作用に加え、生体透過性の高い近赤外レーザー光*6により、インドシアニングリーンに由来するがん患部の可視化とカーボンナノホーンに由来する光熱変換による多次元的な治療が可能であることを実証した。さらに、マウスを用いた生体適合性試験などを行い、いずれの検査からもナノ粒子が生体に与える影響は極めて少ないことがわかった。当該ナノ粒子と近赤外レーザー光を組み合わせた新たながん診断・治療技術の創出が期待される。 |
【研究背景と内容】
がんは世界における死亡の主な原因の1つである。世界保健機関 (WHO) によると、2020年には約1,000万人のがん患者が亡くなっている。とりわけ先進国の人口の高齢化と生活習慣の要因により、症例数は引き続き増加すると予想されている。科学、技術、社会の発展が大きく進歩したにもかかわらず、従来の抗がん剤の特異性の低さ、重篤な副作用、転移性疾患に対する有効性の限界などが相まって、がんは依然として重要かつ世界的な健康課題となっている。従って、より効果的かつ安心・安全な先進がん診断・治療技術の開発は急務である。
イオン液体は、低融点、低揮発性、高イオン濃度、高イオン伝導性などの特長を持つ室温で液体として存在する塩であり、コンデンサ用電解液や帯電防止剤、CO2吸収剤などの様々な産業用途に応用されており、とりわけ環境・エネルギー分野で注目されている。また、近年イオン液体に抗がん作用があることが見出されており、上記の分野のみならず医療分野への応用展開も期待されている。
そもそもイオン液体という物質は、陽イオン分子と陰イオン分子という極めてシンプルな2種類の構成要素で成り立っている。つまり、陽イオン側と陰イオン側の両方に多様な可能性があることから、両者の組み合わせとなるイオン液体には、膨大な種類が存在しうることになる。そのためイオン液体は「デザイナー溶媒」と呼ばれている。例えば、陽イオンが1-ブチル-3-メチルイミダゾリウム、陰イオンが塩化鉄であるイオン液体([Bmin][FeCl4])は、ネオジム磁石程度の磁場に応答する「磁性イオン液体」として知られている。磁石に反応する流体としては、この磁性イオン液体の他に、磁性流体という粉末磁石を懸濁させた油などが知られている。しかし、従来の磁性流体は、固体と液体に分離してしまいやすく不安定であった。磁性イオン液体は極めて安定であり、揮発せず、燃えないなどのイオン液体特有の性質を保持している。このため磁性イオン液体は、固体磁石にはできなかった液体磁石の新しい用途に向けて応用が期待されている。しかし、このような磁性イオン液体の高い潜在能力に反して、これまで報告されている磁性イオン液体の応用例は、化学物質の抽出や分離に限られていた。
一方、ナノ炭素材料の一つであるカーボンナノホーン(CNH)は、高い生体適合性と優れた物理化学的特性を有することが知られており、とりわけバイオメディカル分野で大きな注目を集めている。都教授は、CNHが生体透過性の高い波長領域(650~1100 nm)のレーザー光により容易に発熱する特性(光発熱特性)を世界に先駆けて発見し、当該光発熱特性を活用したがん診断・治療技術の開発を推進している(※1)。また、都研究室では、革新的がん診断・治療技術に向けてCNHのさらなる高性能化・高機能化に取り組んでいる(※2)。
(※1) https://www.jaist.ac.jp/whatsnew/press/2020/08/17_2.html
(※2) https://www.jaist.ac.jp/whatsnew/press/2024/08/22-1.html
本研究では、磁性イオン液体([Bmin][FeCl4])と光発熱素材(CNH)を複合化した新規ナノ粒子を開発し、がん診断・治療技術への可能性を調査した。より具体的には、[Bmin][FeCl4]、近赤外蛍光色素(インドシアニングリーン)、分散剤(ポリエチレングリコール-リン脂質複合体)を被覆したCNH([Bmin][FeCl4]‒PEG‒ICG‒CNH複合体)をがん患部に同時に送り込むことで、[Bmin][FeCl4]に由来する磁場応答性と抗がん作用に加え、生体透過性の高い近赤外レーザー光を用いることで、インドシアニングリーンに由来する近赤外蛍光特性を用いた患部の可視化やCNHに由来する光熱変換を利用した、新たながんの診断や治療の実現を目指した。
当該目標を達成するために、今回開発した技術では、簡便な超音波照射によって[Bmin][FeCl4]、近赤外蛍光色素(インドシアニングリーン)、ポリエチレングリコール-リン脂質複合体をCNH表面に吸着させることで、CNHを水溶液中に分散できるようにした(図1)。この方法で作製した[Bmin][FeCl4]‒PEG‒ICG‒CNH複合体は、7日以上の粒径安定性を有していること、細胞に対し高い膜浸透性を有し抗がん作用を発現すること、近赤外レーザー光照射により発熱が起こることが確認できたため、がん患部の可視化と治療効果について試験を行った。
大腸がんを移植して約10日後のマウスに、当該[Bmin][FeCl4]‒PEG‒ICG‒CNH複合体を尾静脈から投与し、医療用バンデージを使って患部に小型のネオジウム磁石を24時間張り付けた後に740~790 nmの近赤外光を当てたところ、がん患部が蛍光を発している画像が得られた(図2A)。また、当該ナノ粒子が、ネオジウム磁石を用いない場合や磁性イオン液体を被覆していないナノ粒子(PEG‒ICG‒CNH複合体)に比較して、がん組織に効果的に取り込まれていることが分かった(図2A)。そこで、当該ナノ粒子([Bmin][FeCl4]‒PEG‒ICG‒CNH複合体 + 磁場)が集積した患部に対して808 nmの近赤外レーザー光を照射したところ、[Bmin][FeCl4]に由来する抗がん作用に加え、CNHの光熱変換による効果で5日後には、がんを完全に消失させることが判明した(図2B)。
一方、腫瘍内における薬効メカニズムを組織学的評価により調査したところ、とりわけ磁場印可とレーザー照射した[Bmin][FeCl4]‒PEG‒ICG‒CNH複合体においてがん細胞組織の顕著な破壊が起こることが明らかとなった。
さらに、[Bmin][FeCl4]‒PEG‒ICG‒CNH複合体をマウスの静脈から投与し、生体適合性を組織学的検査、血液検査、体重測定により評価したが、いずれの項目でも[Bmin][FeCl4]‒PEG‒ICG‒CNH複合体が生体に与える影響は極めて少ないことがわかった。
これらの成果は、今回開発した[Bmin][FeCl4]‒PEG‒ICG‒CNH複合体が、革新的がん診断・治療法の基礎に成り得ることを示すだけでなく、ナノテクノロジーや光学といった幅広い研究領域における材料設計の技術基盤として貢献することを十分期待させるものである。
本成果は、2025年3月3日に生物・化学系のトップジャーナル「Small Science」誌(Wiley発行)のオンライン版に掲載された。なお、本研究は、文部科学省科研費 基盤研究(A)(23H00551)、文部科学省科研費 挑戦的研究(開拓)(22K18440)、国立研究開発法人科学技術振興機構(JST) 研究成果最適展開支援プログラム (A-STEP)(JPMJTR22U1)、大学発新産業創出基金事業スタートアップ・エコシステム共創プログラム(JPMJSF2318)ならびに本学超越バイオメディカルDX研究拠点、本学生体機能・感覚研究センターの支援のもと行われたものである。
 図1.様々な機能性分子を被覆したナノ粒子の作製と本研究の概念。
図1.様々な機能性分子を被覆したナノ粒子の作製と本研究の概念。
CNH: カーボンナノホーン、ICG: インドシアニングリーン、[Bmim][FeCl4]: 磁性イオン液体、
DSPE‒PEG2000‒NH2: ポリエチレングリコール-リン脂質複合体。
 図2. ナノ粒子をがん患部に集積・可視化(A)し、光照射によりがんを治療(B)
図2. ナノ粒子をがん患部に集積・可視化(A)し、光照射によりがんを治療(B)
(赤色の囲いは腫瘍の位置、赤色の矢印は消失した腫瘍の位置をそれぞれ示している)。
【論文情報】
| 掲載誌 | Small Science |
| 論文題目 | Multifunctional magnetic ionic liquid-carbon nanohorn complexes for targeted cancer theranostics |
| 著者 | Yun Qi, Eijiro Miyako* |
| 掲載日 | 2025年3月3日にオンライン版に掲載 |
| DOI | 10.1002/smsc.202400640 |
【用語説明】
飯島澄男博士らのグループが1998年に発見したカーボンナノチューブの一種。直径は2~5 nm、長さ40~50 nmで不規則な形状を持つ。数千本が寄り集まって直径100 nm程度の球形集合体を形成している。とりわけ、薬品の輸送用担体として期待されており、バイオメディカル分野で注目を集めている。
磁気力によってイオンが移動する液体。
肝機能検査に用いられる緑色色素のこと。近赤外レーザー光を照射すると近赤外蛍光と熱を発することができる。
ポリエチレングリコールとリンを含有する脂質(脂肪)が結合した化学物質。脂溶性の薬剤を可溶化させる効果があり、ドラッグデリバリーシステムによく利用される化合物の一つ。
100nm以下のサイズに粒径が制御された微粒子は、正常組織へは漏れ出さず、腫瘍血管からのみ、がん組織に到達して患部に集積させることが可能である。これをEPR効果(Enhanced Permeation and Retention Effect)という。
レーザーとは、光を増幅して放射するレーザー装置、またはその光のことである。レーザー光は指向性や収束性に優れており、発生する光の波長を一定に保つことができる。とくに700~1100 nmの近赤外領域の波長の光は生体透過性が高いことが知られている。
令和7年3月6日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2025/03/06-1.htmlがんを欺くためのがん細胞の顔をしたナノ粒子の開発に成功 -マウス体内のがんを高感度検出・効果的治療が可能に!-

がんを欺くためのがん細胞の顔をしたナノ粒子の開発に成功
-マウス体内のがんを高感度検出・効果的治療が可能に!-
【ポイント】
- カーボンナノホーンにがん細胞成分と抗がん剤を吸着させた複合体の作製に成功
- 当該ナノ粒子の高い血中滞留性、腫瘍内浸潤作用、EPR効果により腫瘍に集積し、マウスに移植したがんの可視化と、免疫賦活化作用、抗がん作用、光熱変換によるがん治療が可能であることを実証
- 当該ナノ粒子と近赤外光を組み合わせた新たながん診断・治療技術の創出に期待
| 北陸先端科学技術大学院大学(学長・寺野 稔、石川県能美市)物質化学フロンティア研究領域の都 英次郎准教授らは、カーボンナノホーン*1表面にがん細胞成分と抗がん剤を被覆したナノ粒子の作製に成功した(図1)。得られたナノ粒子は、ナノ粒子特有のEPR効果*2のみならず、がん細胞成分に由来する血中滞留性、腫瘍標的能によって、大腸がんを移植したマウス体内の腫瘍内に効果的に集積し、がん細胞成分に由来する免疫賦活化効果と抗がん剤に由来する薬効に加え、生体透過性の高い近赤外レーザー光*3により、がん患部の可視化と光熱変換による多次元的な治療が可能であることを実証した。さらに、マウスを用いた生体適合性試験などを行い、いずれの検査からもナノ粒子が生体に与える影響は極めて少ないことがわかった。当該ナノ粒子と近赤外レーザー光を組み合わせた新たながん診断・治療技術の創出が期待される。 |
【研究背景と内容】
ナノ炭素材料の一つであるカーボンナノホーン(CNH)は、高い生体適合性と優れた物理化学的特性を有することが知られており、とりわけバイオメディカル分野で大きな注目を集めている。都准教授は、CNHが生体透過性の高い波長領域(650~1100 nm)のレーザー光により容易に発熱する特性(光発熱特性)を世界に先駆けて発見し、当該光発熱特性を活用したがん診断・治療技術の開発を推進している[例えば、Nature Communications 11, 4117 (2020).]。
CNHは、そのまま水などに分散させようとすると、分子間の強い相互作用により、粒状に凝集してしまう。CNHの光発熱特性を発揮させるためには、この凝集状態を解消しCNHを溶媒中にナノレベルで分散させる必要がある。従来法としては、ポリエチレングリコール(PEG)などの水溶性ポリマーをCNH表面に化学的に被覆することで水中分散性を改善させる手法がある。しかし、PEG修飾したナノ粒子を繰り返し投与した際、2回目投与時において、従来の高い血中滞留性が損なわれ、血中から速やかに消失するという現象[Accelerated blood clearance(ABC)現象]が報告されているだけでなく、PEGそのものが重篤なアレルギー反応を引き起こす可能性があるため、代替材料の開発が急務となっている。
がん細胞は、免疫細胞からの攻撃回避のために特殊な細胞膜機能を有している。また、堅牢な腫瘍構造を維持するために、がん細胞同士の癒着・親和性を高めることが可能となる特別な細胞膜成分で構成されている。さらに、がん細胞内の構成成分(遺伝子やタンパク質など)には免疫活性を高める効果があることが知られている。そこで本研究グループは、これらのがん細胞成分(細胞膜、遺伝子、タンパク質など)をCNHに搭載することができれば、CNHのマウス体内における血中滞留性、腫瘍内浸潤性、免疫活性などを高めることができるのではないかと考え、研究をスタートさせた。より具体的には、がん細胞成分と抗がん剤を被覆したCNHをがん患部に同時に送り込むことで、がん細胞成分に由来する上記の血中滞留効果、腫瘍内浸潤作用、免疫賦活化能に加え、抗がん剤に由来する薬効と共に、生体透過性の高い近赤外レーザー光を用いることで、患部の可視化やCNHに由来する光熱変換を利用した、新たながんの診断や治療の実現を目指した。
当該目標を達成するために、今回開発した技術では、簡便な超音波照射によってがん細胞成分をCNH表面に吸着させることで、CNHを水溶液中に分散できるようにした。また、がん細胞成分を活用することで、水に不溶な抗がん剤[パクリタキセル(PTX)]もCNH表面に同時に被覆することに成功した(図1)。この方法で作製したがん細胞成分-PTX-CNH複合体は、30日以上の粒径安定性を有していること、細胞に対し高い膜浸透性を有し抗がん作用を発現すること、近赤外レーザー光照射により発熱が起こることが確認できたため、がん患部の可視化と治療効果について試験を行った。なお、がん患部の可視化には、がん診断に利用可能な近赤外蛍光色素[インドシアニングリーン(ICG)]をがん細胞成分と共にCNH表面に結合させたナノ粒子(がん細胞成分-ICG-CNH複合体)を利用した。
大腸がんを移植して約10日後のマウスに、当該がん細胞成分-ICG-PTX-CNH複合体を尾静脈から投与し、24時間後に740~790 nmの近赤外光を当てたところ、がん患部が蛍光を発している画像が得られた(図2A)。また、当該ナノ粒子が、非イオン性のポリエトキシ化界面活性剤(クレモフォールEL)で被覆した従来型の水溶性ポリマーで被覆したCNH(CRE-ICG-CNH複合体)に比較して、がん組織に効果的に取り込まれていることが分かった(図2A)。そこで、当該ナノ粒子(がん細胞成分-PTX-CNH複合体)が集積した患部に対して808 nmの近赤外レーザー光を照射したところ、がん細胞成分に由来する血中滞留効果、腫瘍内浸潤作用、免疫賦活化能と抗がん剤に由来する薬効に加え、CNHの光熱変換による効果で2日後には、がんを完全に消失させることに成功した(図2B)。
一方、腫瘍内における薬効メカニズムを組織学的評価により調査したところ、とりわけレーザー照射したがん細胞成分-PTX-CNH複合体において細胞障害性の高いT細胞やナチュラルキラー細胞などの免疫細胞が活性化されていることが明らかとなった。
さらに、がん細胞成分-PTX-CNH複合体をマウスの静脈から投与し、生体適合性を血液検査(1週間調査)と体重測定(約1ヵ月調査)により評価したが、いずれの項目でもがん細胞成分-PTX-CNH複合体が生体に与える影響は極めて少ないことがわかった。
これらの成果は、今回開発したがん細胞成分のナノ粒子コーティング技術が、革新的がん診断・治療法の基礎に成り得ることを示すだけでなく、ナノテクノロジーや光学といった幅広い研究領域における材料設計の技術基盤として貢献することを十分期待させるものである。
本成果は、2024年8月19日に生物・化学系のトップジャーナル「Small Science」誌(Wiley発行)のオンライン版に掲載された。なお、本研究は、文部科学省科研費 基盤研究(A)(23H00551)、文部科学省科研費 挑戦的研究(開拓)(22K18440)、国立研究開発法人科学技術振興機構(JST) 研究成果最適展開支援プログラム (A-STEP)(JPMJTR22U1)、公益財団法人発酵研究所、公益財団法人上原記念生命科学財団、ならびに本学超越バイオメディカルDX研究拠点、本学生体機能・感覚研究センターの支援のもと行われたものである。
 図1.がん細胞成分を被覆したナノ粒子の作製と本研究の概念。
図1.がん細胞成分を被覆したナノ粒子の作製と本研究の概念。
CNH: カーボンナノホーン、PTX: パクリタキセル。
 図2. ナノ粒子をがん患部に集積・可視化(A)し、光照射によりがんを治療(B)
図2. ナノ粒子をがん患部に集積・可視化(A)し、光照射によりがんを治療(B)
(赤色の囲いは腫瘍の位置を示している)。
【論文情報】
| 掲載誌 | Small Science |
| 論文題目 | Biomimetic functional nanocomplexes for photothermal cancer chemo-immunotheranostics |
| 著者 | Nina Sang, Yun Qi, Shun Nishimura, Eijiro Miyako* |
| 掲載日 | 2024年8月19日にオンライン版に掲載 |
| DOI | 10.1002/smsc.202400324 |
【用語説明】
飯島澄男博士らのグループが1998年に発見したカーボンナノチューブの一種。直径は2~5 nm、長さ40~50 nmで不規則な形状を持つ。数千本が寄り集まって直径100 nm程度の球形集合体を形成している。とりわけ、薬品の輸送用担体として期待されており、バイオメディカル分野で注目を集めている。
100 nm以下のサイズに粒径が制御された微粒子は、正常組織へは漏れ出さず、腫瘍血管からのみ、がん組織に到達して患部に集積させることが可能である。これをEPR効果(Enhanced Permeation and Retention Effect)という。
レーザーとは、光を増幅して放射するレーザー装置、またはその光のことである。レーザー光は指向性や収束性に優れており、発生する光の波長を一定に保つことができる。とくに700~1100 nmの近赤外領域の波長の光は生体透過性が高いことが知られている。
令和6年8月22日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2024/08/22-1.html革新的ポリマーを用いたタンパク質凝集阻害メカニズムの解明 ―タンパク質医薬品製造の効率化や神経変性疾患治療への応用に期待―

  |
国立大学法人 国立大学法人東京工業大学 |
革新的ポリマーを用いたタンパク質凝集阻害メカニズムの解明
―タンパク質医薬品製造の効率化や神経変性疾患治療への応用に期待―
ポイント
- 双性イオンポリマー(PSPB)によるタンパク質凝集阻害の複雑な分子メカニズムを先駆的に解明した。
- PSPBは、多様なタンパク質の熱凝集に対して高い保護活性を持ち、PSPBとタンパク質の相互作用を実験及びシミュレーションにより包括的かつ詳細に検討した結果、弱く可逆的な結合の重要性を明らかにした。また、PSPBはタンパク質と弱く可逆的に相互作用することで、凝集経路を妨げ、凝集性中間体の形成を阻止することも明らかとなった。
- タンパク質治療薬の安定化と長期保存を実現する可能性を見出した。
- 将来的にはアルツハイマーなどの神経変性疾患の治療への応用も期待される。
| 北陸先端科学技術大学院大学(学長・寺野稔、石川県能美市)物質化学フロンティア研究領域の松村和明教授、ラジャンロビン元助教及びZHAO, Dandan研究員(超越バイオメディカルDX研究拠点)は、東京工業大学(学長・益一哉、東京都目黒区)生命理工学院生命理工学系の古田忠臣助教と共同で、双性イオンポリマーによるタンパク質凝集阻害メカニズムの解明に成功した。 本研究グループが合成したスルホベタインポリマーと呼ばれる双性イオン高分子は、タンパク質と弱く可逆的に相互作用し、凝集経路を妨げることで凝集性中間体の形成を阻止し、有害な凝集を防ぐ。この画期的な発見は、タンパク質治療薬を進歩させ、タンパク質のミスフォールディングに関連する様々な症状に対する新規治療法を開発する上で、計り知れない可能性を秘めている。 本成果は、2024年5月30日11時(米国東部標準時間)にCell Press発行「Cell Reports Physical Science」オンライン版に掲載された。 |
【研究の背景】
タンパク質の凝集は、アルツハイマー病、パーキンソン病、ハンチントン病などの神経変性疾患の主な原因とされている。また、タンパク質医薬品の生産と保管中に凝集が発生すると、薬剤の活性と有効性が失われる可能性がある。従来の方法では、これらの凝集を防ぐことは困難であり、効果的な安定化手法の開発が求められていた。
【研究内容】
本研究グループは、双性イオン高分子注1の一種であるスルホベタインポリマー(PSPB)及びその疎水性誘導体がタンパク質凝集を抑制するメカニズムを解明した。(図1)。PSPBはタンパク質と弱く相互作用し、凝集経路を妨げることで凝集性中間体の形成を阻止する。実験により、PSPBがインスリンやリゾチームなどの複数のタンパク質を熱ストレスから効果的に保護することが示された。特に、疎水性残基を導入したPSPBは、タンパク質の凝集抑制効果が著しく向上することが確認された。この効果は分子シールディング効果注2と呼ばれ、保護対象のタンパク質と保護高分子が可逆的な相互作用を示すことにより、物理的に凝集を妨げている様子が分子動力学シミュレーション注3の結果からも確認された。
【主な結果】
- PSPBの合成と特性評価:異なる疎水性モノマー(BuMA、HxMA、OcMA)を組み込んだ種々のスルホベタインポリマー(PSPB)を合成し、その特性を評価した。
- タンパク質の保護効果:インスリン、リゾチーム、乳酸脱水素酵素(LDH)をモデルタンパク質として使用し、PSPBがこれらタンパク質の凝集繊維形成を著しく抑制することを確認。分子量と疎水性が高いPSPBは、特に効果的であることが示された(図2)。
- 分子動力学シミュレーション:PSPBが分子シールドとして機能し、タンパク質分子間の距離を保ち、凝集を防ぐ効果を持つことが確認された(図3)。
- メカニズムの解明:熱分析、分光学的手法などを駆使し、PSPBによる凝集抑制効果の解明に成功した。モデルタンパク質のインスリンを加熱すると、タンパク質の高次構造がほどけるアンフォールディングが起こる。その後、さらに加熱することで凝集性の前駆体が形成され、不可逆な凝集体となる。ここにPSPBが存在することで、アンフォールディングする温度が高温側にシフトし、凝集前駆体の形成が阻害される。冷却時にはPSPBは脱離し、元の高次構造が維持される(図4)。PSPBへの疎水基の導入は、タンパク質の疎水性残基との相互作用を高める効果があり、より凝集前駆体の形成阻害効果を高めていることが示唆される。
【今後の展望】
PSPBによるタンパク質凝集抑制効果の分子メカニズムに迫った研究は初めてであり、このメカニズムにより、PSPBがタンパク質治療薬の安定化と長期保存に貢献できる可能性が示された。
さらに、この研究は新しい診断及び治療法の開発にも応用される可能性があり、将来的には幅広い疾患に対する効果的な治療法の提供が期待される。本研究グループは、今後さらにアミロイドβタンパクの凝集抑制などの研究を進め、アルツハイマー病やパーキンソン病などのタンパク質凝集が原因とされる神経変性疾患の治療や原因解明など、実用化に向けた具体的な応用方法の開発に取り組んでいく予定である。

図1 各種合成した双性イオンポリマー
スルホベタインポリマー(PSPB)にブチルメタクリレート(BuMA)、ヘキシルメタクリレート(HxMA)、オクチルメタクリレート(OcMA)を共重合したポリマーの構造を示す。

図2 インスリン溶液の凝集抑制の様子。i)加熱前、ii)加熱後、iii)PSPB添加後に加熱。
加熱することで凝集により白濁していることが確認される。一方、PSPBを添加することで白濁は抑えられる。

図3 P(SPB-r-BuMA)のモデルとしたスルホベタイン2量体にブチルメタクリレートを結合した化合物(SPB2_BuMA)とインスリンのMDシミュレーションによるスナップショット。インスリン二分子の間にモデル化合物が分子シールドとして可逆的にサンドイッチされ、凝集を妨げている様子が見られた。

図4 凝集抑制メカニズムの模式図。インスリン二量体(天然構造)が加熱により単量体に変性し、さらにアンフォールディングして立体構造が解消される。その際にポリマーがあると、分子シールディング効果により、凝集前駆体の形成を抑制し、繊維状凝集前駆体(prefibrillar aggregates)から繊維凝集体(mature fibrils)の形成を阻害する。
なお、本研究は、科研費基盤研究(B)20H04532、若手研究20K20197、23K17211、学術変革領域研究(A)21H05516、国立研究開発法人科学技術振興機構(JST)研究成果最適展開支援プログラム(A-STEP)JPMJTR20UN、文部科学省ナノテクノロジープラットフォーム事業JPMXP09S21MS1051、JPMXP09S21MS1051b、文部科学省マテリアル先端リサーチインフラ事業JPMXP1222MS1007、ならびに北陸先端科学技術大学院大学超越バイオメディカルDX研究拠点、生体機能・感覚研究センターの支援のもと行われた。
【論文情報】
| 雑誌名 | Cell Reports Physical Science |
| 題目 | Molecular mechanism of protein aggregation inhibition with sulfobetaine polymers and their hydrophobic derivatives |
| 著者 | Robin Rajan, Tadaomi Furuta, Dandan Zhao, Kazuaki Matsumura |
| 掲載日 | 2024年5月30日11時(米国東部標準時間) |
| DOI | 10.1016/j.xcrp.2024.102012 |
【用語説明】
同一分子内に正電荷と負電荷を持つ全体としては中性の高分子で、高い水和性と低い非特異的タンパク質吸着性を持つ。これにより、生体適合性が高く、医療分野やバイオテクノロジー分野で広く研究、応用されている。
Tunaccliffeらの報告によると、ある種の天然変性タンパク質が乾燥時に他のタンパク質の周りに保護相を形成し、物理的に凝集を抑制する効果のことを分子シールディング(molecular shielding)効果として説明している。
Chakrabortee S, et al., Mol. Biosys. 2012, 8, 210-219
分子系の運動を時間的に解析する手法。具体的には、原子や分子の初期位置と速度を設定し、相互作用ポテンシャルを用いてニュートンの運動方程式を解くことで、分子系の時間発展を追跡し、構造変化、相転移、拡散などの現象を解析する。例えば、タンパク質のフォールディング過程や薬物分子の結合動態、材料の熱物性などを詳細に調べることができ、生物学、化学、材料科学に広く応用されている。
令和6年5月31日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2024/05/31-1.html化学修飾細菌を利用するがん光免疫療法の開発に成功

化学修飾細菌を利用するがん光免疫療法の開発に成功
ポイント
- 天然の紅色光合成細菌の細胞表面を簡便に化学修飾可能な手法を開発
- 作製した化学修飾細菌は、免疫細胞の効果的な賦活化のみならず、高い腫瘍標的能を有し、近赤外光によって様々な機能を発現可能
- 当該化学修飾細菌の特性と近赤外レーザー光を組み合わせた、新たながん光免疫療法を開発
| 北陸先端科学技術大学院大学(学長・寺野 稔、石川県能美市)、先端科学技術研究科 物質化学フロンティア研究領域の都 英次郎准教授の研究グループは、光と化学修飾細菌を使ってマウス体内のがん診断・治療を可能にする技術の開発に成功した(図1)。 |
 図1. 化学修飾細菌を利用するがん光免疫療法の概念
図1. 化学修飾細菌を利用するがん光免疫療法の概念
近年、低酸素状態の腫瘍内部で選択的に集積・生育・増殖が可能な細菌を利用したがん標的治療に注目が集まっている。しかし、従来のがん細菌療法は、基本的には抗がん剤の運搬という、いわゆる従来型のドラッグデリバリーシステムの概念を出ない。また、薬効も十分であるとはいえない。さらに、従来のがん細菌療法は、抗がん活性を発現するためには、遺伝子工学を用いた微生物の操作・改変が必須である。米国や欧州ではヒトへの臨床試験が行われ第3相試験に進んでいる例もあるが、使用される細菌は、多くの場合、遺伝子組換えによって弱毒化したサルモネラ菌やリステリア菌であり、体内で再び強毒化するリスクを常に伴っている。
本研究では、低酸素状態の腫瘍環境内で高選択的に集積・生育・増殖が可能で、かつ生体透過性の高い近赤外レーザー光*1によって様々な機能を発現する非病原性かつ天然の紅色光合成細菌*2の表面化学修飾法を開発した。また、当該化学修飾細菌の特性を活用することで体内の腫瘍を高選択的に検出し、効果的な免疫細胞(特にT細胞*3)の賦活化、および標的部位のみを効果的に排除することが可能ながん光免疫療法を開発することに成功した。
本研究を実現するために、がん細胞に対する傷害性の高いT細胞を賦活化可能な免疫チェックポイント阻害剤(抗PD-L1抗体*4)および生体適合性の高いポリエチレングルコール(PEG)脂質から成る機能性高分子複合体と、紅色光合成細菌を生理食塩水中で30分間混合し、洗浄するだけで、免疫賦活化作用と腫瘍標的能を有し、かつ生体透過性の高い近赤外レーザー光によって近赤外蛍光と熱を発現する化学修飾細菌を開発した(図2A)。また、当該細菌のこれらの特性を活用し、近赤外レーザー光照射と組み合わせることで、体内の腫瘍(大腸がん由来)を高選択的に検出し、光発熱作用と免疫の力によって標的部位を効果的に排除することが可能ながん光免疫療法を構築した(図2B、2C)。さらに、マウス大腸がん細胞、マウスマクロファージ細胞、ヒト正常肺細胞を用いた細胞毒性試験、ならびにマウスを用いた生体適合性試験(血液学的検査、組織学的検査など)を行った結果、いずれの検査からも化学修飾細菌そのものが生体に与える影響は極めて少ないことがわかった。
これらの成果は、今回開発した簡便な細菌の表面化学修飾法が、がん光診断・治療法の基礎に成り得ることを示すだけでなく、界面化学、ナノ・マイクロテクノロジー、光学、微生物工学といった幅広い研究領域における材料設計の技術基盤として貢献することを期待させるものである。
本成果は、2023年8月14日(現地時間)にナノテクノロジー分野の世界最高峰「Nano Today」誌(エルゼビア社発行)のオンライン版に掲載された。なお、本研究は、文部科学省科研費 基盤研究(A)(23H00551)、文部科学省科研費 挑戦的研究(開拓)(22K18440)、国立研究開発法人科学技術振興機構(JST) 研究成果最適展開支援プログラム (A-STEP)(JPMJTR22U1)、公益財団法人発酵研究所、公益財団法人上原記念生命科学財団、ならびに本学超越バイオメディカルDX研究拠点、本学生体機能・感覚研究センターの支援のもと行われたものである。
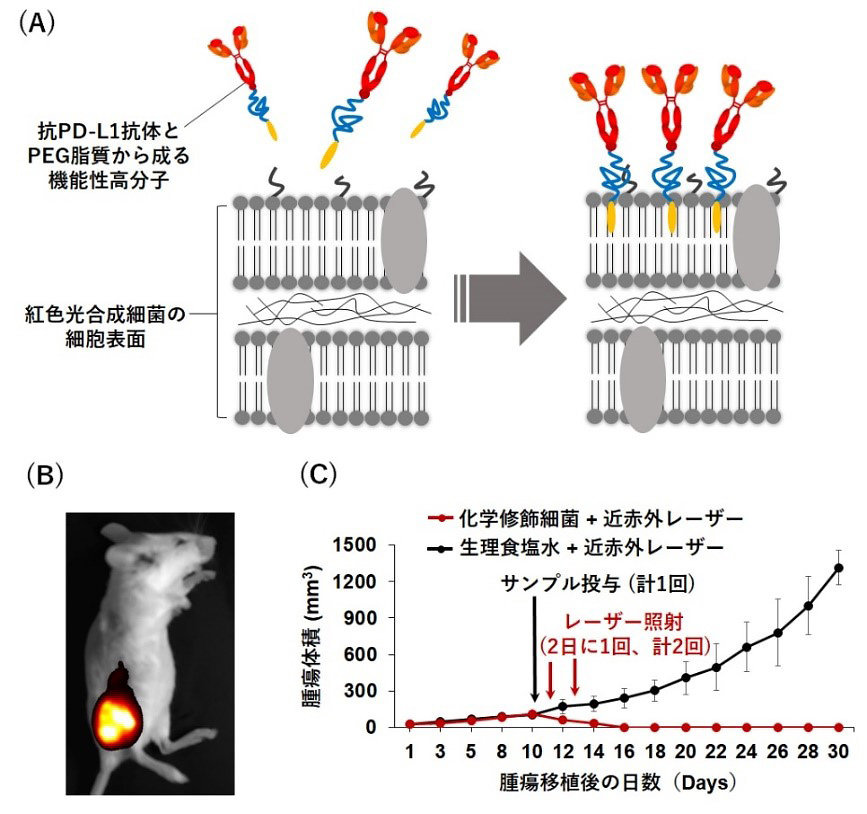
|
図2.(A) 化学修飾細菌の調製方法
(B) がん患部における化学修飾細菌の可視化(近赤外蛍光を検出) (C) 化学修飾細菌の抗腫瘍効果 |
【論文情報】
| 掲載誌 | Nano Today(エルゼビア社発行) |
| 論文題目 | Cancer immunotheranostics using bioactive nanocoated photosynthetic bacterial complexes |
| 著者 | Sheethal Reghu, Seigo Iwata, Satoru Komatsu, Takafumi Nakajo, Eijiro Miyako* |
| 掲載日 | 2023年8月14日 |
| DOI | 10.1016/j.nantod.2023.101966 |
【用語説明】
レーザーとは、光を増幅して放射するレーザー装置、またはその光のことである。レーザー光は指向性や収束性に優れており、発生する光の波長を一定に保つことができる。とくに700~1100 nmの近赤外領域の波長の光は生体透過性が高いことが知られている。
近赤外光を利用して光合成を行う細菌。水の分解による酸素発生は行わない。
免疫を担うリンパ球の一種。活性化したT細胞は、サイトカイン(細胞同士の情報伝達を行うタンパク質の総称)を分泌するヘルパー細胞や、がんや感染細胞を殺傷するキラー細胞などのエフェクター細胞に分化する。
細胞上のPD-1に結合してPD-1とPD-L1あるいはPD-L2との結合を阻害し、T細胞の活性化を維持する抗体のこと。
令和5年8月29日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2023/08/29-1.html液体金属ナノ粒子を活用するがん光免疫療法の開発に成功

液体金属ナノ粒子を活用するがん光免疫療法の開発に成功
ポイント
- 免疫賦活化作用を有する多機能性の液体金属ナノ粒子の開発に成功
- 当該液体金属ナノ粒子がEPR効果により腫瘍に集積し、マウスに移植したがんの可視化と、免疫賦活化ならびに光熱変換によるがん治療が可能であることを実証
- 当該ナノ粒子と近赤外光を組み合わせた新たながん診断・治療技術の創出に期待
| 北陸先端科学技術大学院大学(学長・寺野 稔、石川県能美市)、先端科学技術研究科 物質化学フロンティア研究領域の都 英次郎准教授の研究グループは、液体金属ナノ粒子*1を活用した新しいがん光免疫療法の開発に成功した(図1)。 |
ガリウム・インジウム(Ga/In)合金からなる室温で液体の金属(液体金属)は、高い生体適合性と優れた物理化学的特性を有することが知られており、とりわけナノ粒子化した液体金属をバイオメディカル分野に応用する研究に大きな注目が集まっている。都准教授の研究チームでも、免疫賦活化作用のある物質を液体金属に組み合わせ、がん患部に選択的に送り込むことができれば、免疫による高い抗腫瘍作用の発現が期待できるだけでなく、生体透過性の高い近赤外光*2を用いることで、患部の可視化や光熱変換を利用した、新たながんの診断や治療が実現できるのではないかと考え、研究をスタートさせた。
 図1. 近赤外光が液体金属ナノ粒子に当たり、免疫細胞
図1. 近赤外光が液体金属ナノ粒子に当たり、免疫細胞
(T細胞と樹状細胞)を活性化している様子(イメージ)
研究チームは、液体金属をがん患部まで送り、免疫細胞を賦活化させるために、液体金属表面に免疫チェックポイント阻害薬(抗PD-L1抗体*3)、免疫調整薬(イミキミド*4)、蛍光試薬(インドシアニングリーン*5)、ポリエチレングリコール-リン脂質複合体*6を吸着させたナノ粒子の作製を試みた。Ga/In液体金属、イミキミド、インドシアニングリーン、ポリエチレングリコール-リン脂質複合体の混合物に超音波照射後、抗PD-L1抗体を添加し、一晩培養するだけで、球状ナノ粒子の構造を水中で安定的に維持可能な簡便なナノ粒子を形成できることを見出した。この方法で調製した液体金属ナノ粒子は、10日以上の粒径安定性を有していること、細胞に対し高い膜浸透性を有し毒性が無いこと、近赤外光照射により発熱が起こることが確認できたため、がん患部の可視化と治療効果について試験を行った。
大腸がんを移植して1週間後のマウスに、液体金属ナノ粒子を投与し、24時間後に740~790 nmの近赤外光を当てたところ、がん患部だけが蛍光を発している画像が得られ、当該ナノ粒子がEPR効果*7によりがん組織に取り込まれていることが分かった(図2A)。そこで、当該ナノ粒子が集積した患部に対して808 nmの近赤外光を照射したところ、免疫賦活化と光熱変換による効果で14日後には、がんを完全に消失させることに成功した(図2B)。

|
図2.(A) 液体金属ナノ粒子の標的腫瘍内における蛍光特性
(B) 液体金属ナノ粒子による抗腫瘍効果(腫瘍は完全消失) |
さらに、液体金属ナノ粒子の細胞毒性と生体適合性を評価した。2種類の細胞[マウス大腸がん由来細胞(Colon-26)、ヒト胎児肺由来正常線維芽細胞(MRC5)]を培養する培養液中に、液体金属ナノ粒子を、添加量を変えて投与・分散させ、24時間後に細胞内小器官であるミトコンドリアの活性を指標として細胞生存率を測定した結果、細胞生存率の低下は見られず、細胞毒性はなかった。また、液体金属ナノ粒子をマウスの静脈から投与し、生体適合性を血液検査(1週間調査)と体重測定(約1ヵ月調査)により評価したが、いずれの項目でも液体金属ナノ粒子が生体に与える影響は極めて少ないことがわかった。
これらの成果は、今回開発した液体金属ナノ粒子が、がん診断・免疫療法の基礎に成り得ることを示すだけでなく、ナノテクノロジー、光学、免疫学といった幅広い研究領域における材料設計の技術基盤として貢献することを十分期待させるものである。
本成果は、ドイツの化学・生物系トップジャーナル「Advanced Functional Materials」誌(Wiley社発行)に7月28日(現地時間)に掲載された。なお、本研究は、文部科学省科研費 基盤研究(A)(23H00551)、文部科学省科研費 挑戦的研究(開拓)(22K18440)、国立研究開発法人科学技術振興機構(JST) 研究成果最適展開支援プログラム (A-STEP)(JPMJTR22U1)、公益財団法人発酵研究所、公益財団法人上原記念生命科学財団、ならびに本学超越バイオメディカルDX研究拠点、本学生体機能・感覚研究センターの支援のもと行われたものである。
【論文情報】
| 掲載誌 | Advanced Functional Materials(Wiley社発行) |
| 論文題目 | Light-Activatable Liquid Metal Immunostimulants for Cancer Nanotheranostics |
| 著者 | Yun Qi, Mikako Miyahara, Seigo Iwata, Eijiro Miyako* |
| 掲載日 | 2023年7月28日 |
| DOI | 10.1002/adfm.202305886 |
【用語解説】
室温以下あるいは室温付近で液体状態を示す金属のこと。例えば、水銀(融点マイナス約39℃)、ガリウム(融点約30℃)、ガリウム-インジウム合金(融点約15℃)がある。
800~2500 nmの波長の光。とくに700~1100 nmの近赤外領域の波長の光は生体透過性が高いことが知られている。
免疫チェックポイント阻害剤の一つ。がん細胞や抗原提示細胞が発現するPD-L1に結合することによりT細胞上のPD-1との相互作用を阻害する。この結果、T細胞への抑制シグナル伝達が阻害され、T細胞の活性化が維持され、抗腫瘍作用が発現される。
樹状細胞を活性化させることが知られており、早期の基底細胞皮膚がんや特定の皮膚疾患の治療に用いられる薬物。
肝機能検査に用いられる緑色色素のこと。近赤外光を照射すると近赤外蛍光を発することができる。
ポリエチレングリコールとリンを含有する脂質(脂肪)が結合した化学物質。脂溶性の薬剤を可溶化させる効果があり、ドラッグデリバリーシステムによく利用される化合物の一つ。
100nm以下のサイズに粒径が制御された微粒子は、正常組織へは漏れ出さず、腫瘍血管からのみがん組織に到達して患部に集積させることが可能である。これをEPR効果(Enhanced Permeation and Retention Effect)という。
令和5年8月4日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2023/08/04-1.html学生のXIONGさんが、国際シンポジウムEM-NANO2023においてStudent Awardを受賞

学生のXIONG, Weiさん(博士後期課程2年、ナノマテリアル・デバイス研究領域、大島研究室)が第9回有機・無機エレクトロニクス材料とナノテクノロジーに関する国際シンポジウム(EM-NANO2023)において、Student Awardを受賞しました。
EM-NANO2023は令和5年6月5日~8日にかけて金沢市で開催されました。先端的な材料やそれを用いたデバイスに関する研究に関する講演が約300件あり、そのうち、学生発表が約140件ありました。この中で優れた発表を行った学生10名に対し学生優秀賞が授与されました。
*参考:The 9th International Symposium on Organic and Inorganic Electronic Materials and Related Nanotechnologies (EM-NANO2023)
■受賞年月日
令和5年6月7日
■研究題目、論文タイトル等
引張り変形のその場透過電子顕微鏡法によるMoS2ナノシートのリップル構造評価
■研究者、著者
XIONG, Wei
■受賞対象となった研究の内容
2次元材料の構造的な新しさの一つに、2次元材料の伸縮による原子レベルの波紋構造の形成がある。しかし、このような構造に関する実験的な報告はほとんどない。
本研究では、2つの電極間に吊り下げたMoS2ナノシートを伸張できるin-situ透過型電子顕微鏡(TEM)ホルダーを開発し、MoS2ナノシートの原子レベルの波紋構造を観察することに成功した。得られたTEM像を解析したところ、波紋構造はアームチェア方向に沿って形成されていることがわかった。幾何学的位相解析(GPA)法を用いてTEM像を解析することで、波紋構造の周期と振幅を推定することができた。0.26%、0.51%、0.77%、1.02%の引張ひずみでリップル構造の周期と振幅を推定した。その結果、MoS2ナノシートは引っ張りに対して非線形な力学応答を示すことがわかった。
■受賞にあたって一言
It's my honor to receive the "Student Award" in EM-NANO2023. Participating in this academic conference has benefited me a lot. I have listened to many excellent presentations and read many creative posters at this conference. The experiences and conversations during this trip made me think more deeply about my research. I will also put the inspiration and ideas I got at this conference into practice in my future experiments. For this honor, I would like to express my sincere gratitude to my supervisor, Prof. Yoshifumi Oshima, his profound knowledge gave me strong support in my study and research, his peaceful personality made me feel no pressure to get alone with him in life. I also want to thank Dr. Lilin Xie, a graduate of our lab, his research work has given me great convenience and confidence, and it has a great weight in this award I have received. Also, I'd like to thank assistant professor Kohei Aso and the laboratory members for their help in my life, study and research.
令和5年6月15日
下水中の新型コロナウイルス検出・監視により感染拡大防止につなげる下水サーベイランス技術の開発
   |
| BioSeeds株式会社 金沢大学 北陸先端科学技術大学院大学 一般財団法人北陸産業活性化センター |
下水中の新型コロナウイルス検出・監視により
感染拡大防止につなげる下水サーベイランス技術の開発
| 北陸先端科学技術大学院大学(以下、JAIST)発のベンチャー企業であるBioSeeds株式会社を代表とする5機関は、この度、内閣官房公募事業「ウィズコロナ時代の実現に向けた主要技術の実証・導入に係る事業」に申請を行い、採択されましたのでお知らせします。 下水中の新型コロナウイルス検出・監視は、患者から直接新型コロナウイルス(以下、コロナウイルス)を検出するよりも早くコロナウイルスの感染拡大を発見できる効率的な方法です。 今回採択されたのは、内閣官房が公募を行う3つの研究開発領域のうち、コロナウイルス感染拡大防止につなげるための【領域3:下水サーベイランス技術の開発】のプロジェクトです。 (参考) 内閣官房事業(株式会社三菱総合研究所が請負) https://pubpjt.mri.co.jp/publicoffer/20220411.html 地域や大規模なコミュニティで下水を活用したコロナウイルスの感染動態監視を実用化する際、下水からのコロナウイルスの抽出(=濃縮)、分析、データの共有等のステップが必須です。今回採択されたプロジェクトでは、現状の実験室レベルでの検出法は利用に制限があるという課題を解決する対策として、検出現場で簡単・迅速・正確に下水監視が可能な革新的技術の開発を行います。 |
本プロジェクトは、BioSeeds株式会社(代表機関)のほか、JAIST、金沢大学、東京大学、一般財団法人北陸産業活性化センターの5機関連携の体制で進めます。
事業予算は、総額で約14,000千円を予定しています。
BioSeeds株式会社が2021年度に開発した高感度コロナウイルス迅速簡便検査法(以下、RICCA)のノウハウをベースに、定量化可能な検出法(定量型RICCA)への改良を行います。さらに、金沢大学本多了教授の下水中に存在するコロナウイルスの検出・分析技術、JAIST高木昌宏教授の下水マイクロバイオーム解析技術、東京大学一木隆範教授の可搬型PCR装置による検出技術、一般財団法人北陸産業活性化センターのユーザビリティ評価といった、優れた技術を有する連携機関と共に本プロジェクトを推進し、付加価値の高い下水サーベーランスサービスを開発、社会実装することで、コロナウイルス感染症等の新規感染症防止対策と、経済活動の両立を目指します。
【プロジェクトの概要】
研究開発プロジェクト名:
集団感染の早期発見と老人ホーム・診療所などを対象とした予防のため、現場で下水を監視する高感度新型コロナウイルス迅速簡便検査法の開発
プロジェクトマネージャー:
BioSeeds株式会社 代表取締役社長 Biyani Manish(ビヤニ マニシュ)
参画機関:
BioSeeds株式会社、JAIST、金沢大学、東京大学、一般財団法人北陸産業活性化センター
事業期間:
令和4年10月から令和5年3月20日まで
研究開発のイメージ:

1)成果
【会社概要】
BioSeeds株式会社
BioSeeds株式会社は、次の2つの主要な目標によって、人々と環境及び健康を維持・強化することを目指しています。
1) マイクロ・ナノテクノロジーによって発明された新しいツールを提供する「ビジネス'D'」
2) アプタマーを用いた診断薬や治療薬の開発「ビジネス'W'」
【本プレスリリースに関する照会先】
BioSeeds株式会社
ビヤニ、上田 TEL:0761-51-1591
令和4年11月1日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2022/11/01-1.htmlナノ複合化細菌を利用したがん光診断・治療技術の開発に成功

ナノ複合化細菌を利用したがん光診断・治療技術の開発に成功
ポイント
- 機能性色素を封入したナノ粒子と天然のビフィズス菌を水溶液中で一晩混合し、洗浄するだけの簡便な方法で、高い腫瘍標的能を有し、近赤外光によって様々な機能を発現するナノ複合化細菌を創出
- 当該ナノ複合化細菌の特性と近赤外レーザー光を組み合わせた、新たながん光診断・治療技術を開発
| 北陸先端科学技術大学院大学(学長・寺野 稔、石川県能美市)、先端科学技術研究科 物質化学領域の都 英次郎准教授とラグ シータル大学院生(博士後期課程)は、ナノ複合化細菌を使ってマウス体内のがん細胞の蛍光検出と光発熱治療を同時に可能にする技術の開発に成功した。 |
【研究背景と内容】
近年、低酸素状態の腫瘍内部で選択的に集積・生育・増殖が可能な細菌を利用したがん標的治療に注目が集まっている。なかでもビフィズス菌*1を利用するがん標的治療は、その優れた腫瘍選択性と高い安全性などの特徴から有力な微生物製剤として期待されている。しかし、ビフィズス菌に抗腫瘍作用を発現させるためには、通常、煩雑な遺伝子操作が必要である。また、ビフィズス菌を含む細菌を利用するがん標的治療は、基本的には抗がん剤の運搬という、いわゆる従来型のドラッグデリバリーシステム*2の概念を出ない。
本研究では、機能性色素のインドシアニングリーン*3を封入したポリオキシエチレンヒマシ油*4から成るナノ粒子と天然のビフィズス菌を生理食塩水中で一晩混合し、洗浄するだけで、高い腫瘍標的能を有し、生体透過性の高い近赤外レーザー光*5によって近赤外蛍光と熱を発現するナノ複合化細菌の創出に成功した(図1(a),(b))。また、当該細菌のこれらの特性を活用し近赤外レーザー光照射と組み合わせることで、体内の腫瘍を高選択的に検出し、標的部位を効果的に排除することが可能ながん光診断・治療技術を開発することに成功した(図1(c),(d))。さらに、マウスがん細胞とヒト正常細胞を用いた細胞毒性試験、ならびにマウスを用いた生体適合性試験(血液学的検査、組織学的検査など)を行った結果、いずれの検査からもナノ複合化細菌が生体に与える影響は極めて少ないことがわかった。
これらの成果は、今回開発した細菌の簡便なナノ複合化技術が、がん光診断・治療法の基礎に成り得ることを示すだけでなく、ナノ・マイクロテクノロジー、光学、微生物工学といった幅広い研究領域における材料設計の技術基盤として貢献することを十分期待させるものである。
本成果は、2022年2月18日にナノサイエンス・ナノテクノロジー分野のトップジャーナル「Nano Letters」誌(アメリカ化学会発行)のオンライン版に掲載された。なお、本研究は、日本学術振興会科研費(基盤研究A)と公益財団法人上原記念生命科学財団の支援のもと行われたものである。

|
図1.(A) ナノ複合化細菌を利用するがん細胞の蛍光検出と光発熱治療の概念
(B) 機能性色素を封入したナノ粒子との混合前後のビフィズス菌水溶液 (C) がん患部におけるナノ複合化細菌の可視化(近赤外蛍光を検出) (D) ナノ複合化細菌の抗腫瘍効果。蛍光検出されたがん患部に近赤外レーザー光を当てると、 光熱変換による効果によりがんが消失した。 |
【論文情報】
| 掲載誌 | Nano Letters(アメリカ化学会発行) |
| 論文題目 | Nanoengineered Bifidobacterium bifidum with Optical Activity for Photothermal Cancer Immunotheranostics |
| 著者 | Sheethal Reghu, Eijiro Miyako* |
| 掲載日 | 2022年2月18日にオンライン版に掲載 |
| DOI | 10.1021/acs.nanolett.1c04037 |
【関連研究情報】
北陸先端科学技術大学院大学(JAIST)、先端科学技術研究科 物質化学領域の都研究室では、近赤外レーザー光により容易に発熱するナノ材料の特性(光発熱特性)に注目し、これまでに、"三種の神器"を備えた多機能性グラフェン(2020年4月23日 JAISTからプレス発表)、ナノテクノロジーと遺伝子工学のマリアージュ(2020年8月17日 JAISTからプレス発表)、がん光細菌療法の新生(2021年2月16日JAISTからプレス発表)、ナノ粒子と近赤外レーザー光でマウス体内のがんを検出・治療できる!(2021年12月21日JAISTからプレス発表)などの光がん療法を開発している。
【用語説明】
*1 ビフィズス菌
ヨーグルトでおなじみの細菌。主にヒトなどの動物の腸内の小腸下部から大腸にかけて生息する乳酸菌の一種で、いわゆる善玉菌と呼ばれる微生物のことである。整腸作用だけではなく、病原菌の感染や腐敗物を生成する菌の増殖を抑える効果があると考えられている。
*2 ドラッグデリバリーシステム
製剤技術の一つで、疾患部位に必要な薬効成分を届ける技術のこと。
*3 インドシアニングリーン
肝機能検査に用いられる緑色色素のこと。近赤外レーザー光を照射すると近赤外蛍光と熱を発することができる。
*4 ポリオキシエチレンヒマシ油
天然ヒマシ油に由来する、安全性の高い界面活性成分のこと。各種化粧品の可溶化・透明化に使用されている。
*5 近赤外レーザー光
レーザーとは、光を増幅して放射するレーザー装置、またはその光のことである。レーザー光は指向性や収束性に優れており、発生する光の波長を一定に保つことができる。とくに700~1100 nmの近赤外領域の波長の光は生体透過性が高いことが知られている。
令和4年2月21日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2022/02/21-1.htmlレッドビート由来のベタレイン色素がアミロイドβペプチドの凝集を阻害することを発見

  |
石川県公立大学法人 石川県立大学 国立大学法人 北陸先端科学技術大学院大学 |
レッドビート由来のベタレイン色素が
アミロイドβペプチドの凝集を阻害することを発見
| レッドビート由来のベタレイン色素が、アルツハイマー病の原因の一つとされているアミロイドβペプチドの凝集を阻害する効果を様々な分析法を用いて明らかにしました。さらに、アルツハイマー病のモデル線虫を用いた実験においても、その効果を確認することができました。 |
【概要】
石川県立大学の研究グループ(森正之准教授、今村智弘講師、東村泰希准教授、古賀博則客員教授、松本健司教授、高木宏樹准教授)は、北陸先端科学技術大学院大学 生命機能工学領域 大木進野教授と共同で、植物色素ベタレインの一つであるベタニンがアミロイドβペプチドの凝集を抑制する働きを持つことを発見しました。本研究成果は、学術誌「Plant Foods for Human Nutrition」で公表されました。
ベタレイン色素は、植物色素の一つでありオシロイバナやサボテン、雑穀のキヌアなどのナデシコ目植物で主に合成されています。ベタレイン色素は高い抗酸化活性によって、抗がん作用、抗炎症作用、コレステロール(LDL)酸化抑制作用などを持つことが示されており、本研究グループもHIV-1プロテアーゼの阻害活性を持つことを見出しています(参考文献)。このようにベタレイン色素は、多様な生理活性を持つことから、近年その効能に注目が集まっています。
本研究で扱ったレッドビートは、ヒユ科植物であり、ロシアなどで郷土料理「ボルシチ」に用いられています。レッドビートは、根の部分にベタレイン色素(主にベタニン、イソベタニン)を多く蓄積しており(図1)、別名「食べる輸血」と呼ばれ様々な生理機能を持つスーパーフードとして注目されています。
近年、高齢者の増加に伴ってアルツハイマー病による認知症患者数が増加し、罹患者のみならず介護者への肉体的・精神的負担が社会問題となっています。アルツハイマー病の原因の一つとして、アミロイドβ(Aβ)ペプチドが凝集し、脳内に沈着・蓄積することが考えられます。アルツハイマー病に関しては、決定的な治療薬が確立していないため、若い時期から、Aβの蓄積を予防することと、Aβの凝集を阻害することが重要です。
本研究では、レッドビートから抽出・精製したベタレイン色素について、Aβの凝集阻害効果の有無をThTアッセイ、電子顕微鏡、円二色性分光計や核磁気共鳴装置を用いた立体構造解析を用いて評価しました。その結果、レッドビート由来のベタレイン色素はAβの凝集を阻害する活性を持つことを明らかにしました(図2)。さらに、Aβ遺伝子を発現するアルツハイマー病モデル線虫にレッドビート由来のベタレイン色素を与え、線虫の形質出現を遅延させる事を見出しました(図3)。これらの結果より、レッドビート由来のベタレイン色素がAβの凝集を阻害することで、生物のアルツハイマー病態を緩和する機能を有する可能性を見出すことができました。今後の更なる研究により、アルツハイマー病の予防への活用が期待されます。本成果は国際特許(PCT)出願中です。また、分析機器の使用に関して、文部科学省のナノテクノロジープラットフォーム事業の支援を受けました。
【発表論文】
| 論文タイトル | Red-beet betalain pigments inhibit amyloid-β aggregation and toxicity in amyloid-β expressing Caenorhabditis elegans |
| 論文著者 | Tomohiro Imamura, Noriyoshi Isozumi, Yasuki Higashimura, Hironori Koga, Tenta Segawa, Natsumi Desaka, Hiroki Takagi, Kenji Matsumoto, Shinya Ohki, and Masashi Mori |
| 雑誌 | Plant Foods for Human Nutrition |
| DOI | 10.1007/s11130-022-00951-w |
【参考文献】
| 論文タイトル | Isolation of amaranthin synthetase from Chenopodium quinoa and construction of an amaranthin production system using suspension-cultured tobacco BY-2 cells |
| 論文著者 | Tomohiro Imamura, Noriyoshi Isozumi, Yasuki Higashimura, Akio Miyazato, Hiroharu Mizukoshi, Shinya Ohki, and Masashi Mori |
| 雑誌 | Plant Biotechnology Journal |
| DOI | 10.1111/pbi.13032 |

図1 レッドビート(テーブルビート)と、それに含まれるベタレイン色素

図2 レッドビート由来ベタレイン色素のアミロイドβ (Aβ)凝集阻害効果
レッドビート由来のベタレイン色素を加えたものはAβ凝集が観察されない。
(A)透過型電子顕微鏡を用いたAβの観察。スケールバー200 nm。
(B, C)NMRを用いたAβの測定。Aβ単独のNMRシグナル(B)。レッドビート由来のベタレイン色素を加えたAβのNMRシグナル(C)。Day 0のNMRシグナルが凝集していないAβ40のNMRシグナル。
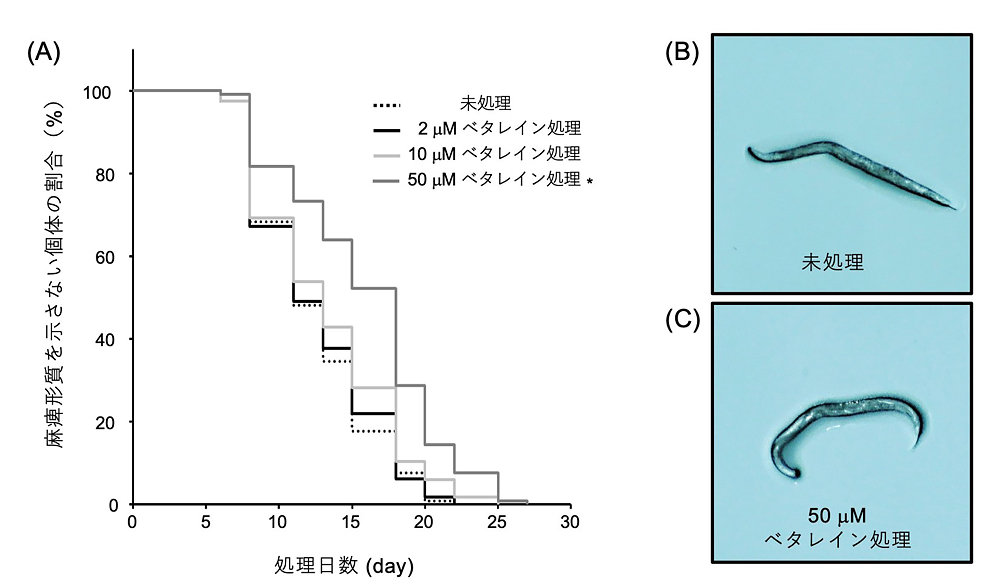
図3 Aβ発現線虫の麻痺形質を利用した評価試験
50 µMレッドビート由来ベタレイン色素の処理は、アルツハイマー病モデル線虫の麻痺形質の発現を遅らせる。
(A)時間経過と共に麻痺形質を示さないAβ発現線虫の割合。
(B)未処理区で観察された麻痺形質を示す線虫。
(C)50 µMベタレイン色素処理区で観察された健常な形質を示す線虫。
【用語説明】
ベタレイン色素: カロテノイド、フラボノイドと共に植物の代表的な色素の1つ。ベタレイン色素は、紫から赤色を示すベタシアニンと黄色から橙色を示すベタキサンチンに分類される。特徴として、分子内にカロテノイド、フラボノイドには見られない窒素原子を持つ。基本骨格としてベタラミン酸を有する。
アルツハイマー病: 記憶、思考、行動に問題を起こす脳の病気。認知症の症例において、アルツハイマー病は、その60-80%を占めるとされている。
アミロイドβ (Aβ): 脳内で作られるたんぱく質から生じるペプチド。アルツハイマー病患者の脳に観察される老人斑の構成成分であり、Aβが重合・凝集することがアルツハイマー病の原因の一つと考えられている。Aβの長さは40アミノ酸残基程度であり代表的なものとして、40アミノ酸残基のAβ40と42アミノ酸残基のAβ42が知られている。
ThTアッセイ: アミロイド線維に特異的に結合し蛍光を発する試薬チオフラビンT(Thioflavin T, ThT)を用いて、アミロイドβペプチドの重合を測定する方法。
円二色性: 試料(光学活性物質)に右回りおよび左回りの円偏光を照射し、その吸収の差を測定して立体構造を解析する手法。
核磁気共鳴(NMR)装置: 強力な磁場中に置いた試料に電磁波を照射して応答信号を得る装置。信号を解析することで、試料の構造や運動性を知ることができる。
令和4年2月15日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2022/02/15-1.htmlナノ粒子と近赤外レーザー光でマウス体内のがんを検出・治療できる! ~ ガンマ線架橋したゼラチン-液体金属ナノ粒子の開発により実現 ~

  |
国立大学法人北陸先端科学技術大学院大学 国立研究開発法人量子科学技術研究開発機構 |
ナノ粒子と近赤外レーザー光でマウス体内のがんを検出・治療できる!
~ ガンマ線架橋したゼラチン-液体金属ナノ粒子の開発により実現 ~
ポイント
- 液体金属に生体分子を吸着させた複合体へのガンマ線照射によりコア-シェル型の構造を持つナノ粒子の作製に成功
- ガンマ線架橋したゼラチン-液体金属ナノ粒子がEPR効果により腫瘍に集積し、マウスに移植したがんの可視化と、光熱変換によるがん治療が可能であることを実証
- 当該ナノ粒子と近赤外光を組み合わせた新たながん診断・治療技術の創出に期待
| 北陸先端科学技術大学院大学(学長・寺野 稔、石川県能美市)、先端科学技術研究科 物質化学領域の都 英次郎准教授とセキ ウン大学院生(博士前期課程)は、量子科学技術研究開発機構(理事長・平野 俊夫、千葉県千葉市)、高崎量子応用研究所 先端機能材料研究部(群馬県高崎市)の田口 光正上席研究員(「生体適合性材料研究プロジェクト」プロジェクトリーダー)、木村 敦上席研究員と共同で、量子ビーム(ガンマ線*1)架橋技術を用いて、ガリウム-インジウム合金から成る液体金属*2 表面に様々な生体高分子(ゼラチン、DNA、レシチン、牛血清蛋白質)がコートされ、安定な状態を保つことができるコア-シェル型*3 のユニークな構造を有すナノ粒子の作製に成功した(図1)。得られたゼラチン-液体金属ナノ粒子は、EPR効果*4 によって大腸がんを移植したマウス体内の腫瘍内に集積し、生体透過性の高い近赤外レーザー光*5 により、がん患部の可視化と光熱変換による治療が可能であることを実証した。さらに、マウスがん細胞とヒト正常細胞を用いた細胞毒性試験と生体適合性試験を行い、いずれの検査からもゼラチン-液体金属ナノ粒子が生体に与える影響は極めて少ないことがわかった。当該ナノ粒子と近赤外レーザー光を組み合わせた新たながん診断・治療技術の創出が期待される。 |
【研究背景と内容】
ガリウム・インジウム(Ga/In)合金からなる室温で液体の金属(液体金属)は、高い生体適合性と優れた物理化学的特性を有することが知られており、とりわけナノ粒子化した液体金属をバイオメディカル分野に応用する研究に大きな注目が集まっている。研究チームでも、液体金属をがん患部に送り込むことができれば、生体透過性の高い近赤外レーザー光を用いることで、患部の可視化や光熱変換を利用した、新たながんの診断や治療が実現できるのではないかと考え、研究をスタートさせた。
液体金属をナノ粒子化するためには煩雑な合成プロセスが必要であり、ナノ粒子化した液体金属の構造や機能を溶媒中で安定的に保持させることは難しい。そこで、研究チームは、液体金属をがん患部まで送り、がん細胞内に取り込ませるために、液体金属表面に生体高分子(ゼラチン、DNA、レシチン、牛血清蛋白質)を吸着させたコア-シェル型ナノ粒子の作製を試みた。Ga/In液体金属と生体分子の混合物に超音波照射することで、コア-シェル型ナノ粒子を形成できることを見出したが、そのままではナノ粒子の構造を水中で安定的に維持させることはできなかった。
この問題を解決するために、ナノ粒子表面の生体高分子がバラバラにならないよう、量子ビーム(ガンマ線)架橋反応を利用すれば、架橋剤などの細胞毒性を有する薬剤を用いることなく、生体高分子の特性を保持したまま安定化できると考えた。この方法でガンマ線架橋したゼラチン-液体金属ナノ粒子は、30日以上の粒径安定性を有していること、細胞に対し高い膜浸透性を有し毒性が無いこと、近赤外レーザー光照射により発熱が起こることが確認できたため、がん患部の可視化と治療効果について試験を行った。
大腸がんを移植して10日後のマウスに、ゼラチン-液体金属ナノ粒子を投与し、4時間後に740~790 nmの近赤外光を当てたところがん患部だけが蛍光を発している画像が得られ、当該ナノ粒子がEPR効果によりがん組織に取り込まれていることが分かった(図2(左))。そこで、当該ナノ粒子が集積した患部に対して808 nmの近赤外レーザー光を照射したところ、光熱変換による効果で26日後には、がんを完全に消失させることに成功した(図2(右))。
さらに、ゼラチン-液体金属ナノ粒子の細胞毒性と生体適合性を評価した。2種類の細胞[マウス大腸がん由来細胞(Colon-26)、ヒト胎児肺由来正常線維芽細胞(MRC5)]を培養する培養液中に、ゼラチン-液体金属ナノ粒子を、添加量を変えて投与・分散させ、24時間後に細胞内小器官であるミトコンドリアの活性を指標として細胞生存率を測定した結果、細胞生存率の低下は見られず、細胞毒性はなかった(図3)。また、ゼラチン-液体金属ナノ粒子をマウスの静脈から投与し、生体適合性を血液検査(1週間調査)と体重測定(約1ヵ月調査)により評価したが、いずれの項目でもゼラチン-液体金属ナノ粒子が生体に与える影響は極めて少ないことがわかった。
これらの成果は、今回開発した生体高分子のナノ粒子コーティング技術が、革新的がん診断・治療法の基礎に成り得ることを示すだけでなく、ナノテクノロジー、光学、量子ビーム工学といった幅広い研究領域における材料設計の技術基盤として貢献することを十分期待させるものである。
本成果は、2021年12月20日に先端材料分野のトップジャーナル「Applied Materials Today」誌(Elsevier発行)のオンライン版に掲載された。なお、本研究は、日本学術振興会科研費(基盤研究A)及び総合科学技術・イノベーション会議 官民研究開発投資拡大プログラム(Public/Private R&D Investment Strategic Expansion PrograM:PRISM)の支援のもと行われたものである。

図1. ガンマ線を利用した生体分子-液体金属ナノ複合体の合成と当該ナノ粒子を活用した光がん療法の概念。
LM: 液体金属、NIR: 近赤外、FL: 蛍光。

図2. ナノ粒子をがん患部に集積・可視化(左)し、光照射によりがんを治療(右)。

図3. CCK-8法によるゼラチン-液体金属ナノ粒子の細胞毒性評価。
赤:マウスの大腸がん細胞、グレー:ヒトの正常細胞、
RIPA: Radioimmunoprecipitation Buffer(細胞や組織の溶解に
使用される緩衝液、本実験の陽性対照に利用)
【論文情報】
| 掲載誌 | Applied Materials Today |
| 論文題目 | Sonication- and γ-ray-mediated biomolecule-liquid metal nanoparticlization in cancer optotheranostics |
| 著者 | Qi Yun, Atsushi Kimura, Mitsumasa Taguchi, Eijiro Miyako* |
| 掲載日 | 2021年12月20日にオンライン版に掲載 |
| DOI | 10.1016/j.apmt.2021.101302 |
【関連研究情報】
北陸先端科学技術大学院大学(JAIST)、先端科学技術研究科物質化学領域の都研究室では、近赤外レーザー光により容易に発熱するナノ材料の特性(光発熱特性)に注目し、これまでに、"三種の神器"を備えた多機能性グラフェン(2020年4月23日 JAISTからプレス発表)、ナノテクノロジーと遺伝子工学のマリアージュ(2020年8月17日 JAISTからプレス発表)、がん光細菌療法の新生(2021年2月16日JAISTからプレス発表)などの光がん療法を開発している。
量子科学技術研究開発機構(QST)、先端機能材料研究部プロジェクト「生体適合性材料研究」では、量子ビーム微細加工技術による先端医療デバイスの創製の一環として、これまでに、診断や創薬における微量検体の分析性能が数10倍に!(2019年6月25日 QSTからプレス発表)、平面状の細胞シートが立体的に!細胞が自分の力でシートを3次元化(2021年7月14日QSTからプレス発表)などの機能性材料作製技術を開発している。
【用語説明】
*1 ガンマ線
ガンマ線とは、放射性同位元素(コバルト60など)の崩解によって放出される量子ビームの一種。
*2 液体金属
室温以下あるいは室温付近で液体状態を示す金属のこと。例えば、水銀(融点マイナス約39℃)、ガリウム(融点約30℃)、ガリウム-インジウム合金(融点約15℃)がある。
*3 コア-シェル型
コアは核、シェルは殻を意味し、一つの粒子で核と殻の素材が異なるものをこのように呼ぶ。
*4 EPR効果
100nm以下のサイズに粒径が制御された微粒子は、正常組織へは漏れ出さず、腫瘍血管からのみがん組織に到達して患部に集積させることが可能である。これをEPR効果(Enhanced Permeation and Retention Effect)という。
*5 近赤外レーザー光
レーザーとは、光を増幅して放射するレーザー装置、またはその光のことである。レーザー光は指向性や収束性に優れており、発生する光の波長を一定に保つことができる。とくに700~1100 nmの近赤外領域の波長の光は生体透過性が高いことが知られている。
令和3年12月21日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2021/12/21-1.html学生のHASANさんが国際会議NANOSYM 2021においてBest Student Paper Awardを受賞

学生のHASAN, Md. Mahmudulさん(博士後期課程3年、物質化学領域、長尾研究室)が国際会議Nanotechnology Malaysia Biennial Symposium(NANOSYM 2021)においてBest Student Paper Awardを受賞しました。
NANOSYM 2021は、マレーシアナノテクノロジー協会(MNA)が主催で、10月11日から13日にかけてオンラインにて開催されました。
■受賞年月日
令和3年10月13日
■研究題目、論文タイトル等
Hierarchical Metal Nanostructures: Synthesis, Characterizations, and Electrocatalysis
(階層的金属ナノ構造:合成、特性評価、および電極触媒作用)
■研究者、著者
Md. Mahmudul Hasan, Yuki Nagao
■受賞対象となった研究の内容
The physical and chemical characteristics of hierarchical metal nanostructures have sparked scientific interest in heterogeneous catalysis and electrocatalysis. Recently, the fabrication of well-defined nanostructures has received a lot of attention. In this study, we have successfully fabricated different hierarchical metal nanostructures and applied for Ascorbic acid (AA) electrooxidation. AA, known as vitamin C, is environment-friendly and releases two electrons during electro-oxidation and could be used as an alternative fuel for a direct liquid fuel cell system. Well-defined hierarchical silver dendrite nanostructures were successfully deposited on the glassy carbon electrode (GCE) by the simple electroless deposition method without using any capping agent, current, pressure, or temperature. This integrated electrode is applied for AA electrooxidation in neutral medium to understand the oxidation pathway. The kinetic study revealed the electron transfer process is stepwise at slower scan rates and concerted at faster scan rates. We have also synthesized Christmas-Tree-Shaped palladium nanostructures featuring many sharp edges on the GCE (Pd/GCE) by a controlled electrodeposition technique. These unique nanostructures showed excellent AA electrocatalytic activity in alkaline solution. These new synthesis processes can play an important role in the preparation of hierarchical metal nanostructures for electrocatalysis.
■受賞にあたって一言
We are honored to win the prize for Best Student Paper Award at NANOSYM 2021. First and foremost, I want to express my gratitude to my supervisor Associate Professor Yuki Nagao for his excellent remarks, suggestions, and guidance. I also appreciate Nagao LAB members for their supports. This award encouraged me to explore more in the field of science and technology.
令和3年12月8日
出典:JAIST 受賞https://www.jaist.ac.jp/whatsnew/award/2021/12/08-1.htmlがん光細菌療法の新生

がん光細菌療法の新生
ポイント
- 高い腫瘍標的能を有し、近赤外光によって様々な機能を発現する光合成細菌の発見
- 当該細菌を活用したがん診断・治療技術の創出
| 北陸先端科学技術大学院大学(学長・寺野稔、石川県能美市)先端科学技術研究科物質化学領域の楊 羲研究員、博士前期課程学生の小松 慧、博士後期課程学生のラグー シータル、都 英次郎准教授らは、光合成細菌を使ってマウス体内のガン細胞の検出と治療を同時に可能にする技術の開発に成功した。 世界的にがんの罹患者数、死亡者数は増加している。体内の高精度ながん細胞検出技術ならびにがん細胞を根絶可能な治療法の開発は、がん医療における究極の目的である。 本研究では、低酸素状態の腫瘍環境内で高選択的に集積・生育・増殖が可能で、かつ生体透過性の高い近赤外レーザー光*1によって様々な機能を発現する非病原性の紅色光合成細菌*2を発見した(図1)。また、当該細菌の特性を活用することで体内の腫瘍を高選択的に検出し、標的部位のみを効果的に排除することが可能な "がん光細菌療法"という新しい概念・技術を創出することに成功した。 本研究で提案する概念・技術は、ナノ・マイクロテクノロジー、光学、微生物工学といった幅広い研究領域に貢献し、将来的に先進医療分野において世界の科学・技術をリード可能な革新的がん診断・治療法に成り得ると期待している。 本成果は、2021年2月15日にナノサイエンス・ナノテクノロジー分野のトップジャーナル「Nano Today」誌(Elsevier発行)のオンライン版に掲載された。なお、本研究成果は日本学術振興会科研費[基盤研究A、国際共同研究加速基金(国際共同研究強化)]の支援のもと行われたものである。 |

図1. がん光細菌療法の概念。NIR: 近赤外、FL: 蛍光、ROS: 活性酸素種、PA: 光音響。 |
【論文情報】
| 掲載誌 | Nano Today(Elsevier発行) |
| 論文題目 | Optically activatable photosynthetic bacteria-based highly tumor specific immunotheranostics |
| 著者 | Xi Yang, Satoru Komatsu, Sheethal Reghu, Eijiro Miyako* |
| 掲載日 | 2021年2月15日にオンライン版に掲載 |
| DOI | 10.1016/j.nantod.2021.101100 |
【関連研究情報】
北陸先端科学技術大学院大学(JAIST)、先端科学技術研究科物質化学領域の都研究室では、近赤外レーザー光により容易に発熱するナノ材料の特性(光発熱特性)に注目し、これまでに、"三種の神器"を備えた多機能性グラフェン(2020年4月23日 JAISTからプレス発表)、ナノテクノロジーと遺伝子工学のマリアージュ(2020年8月17日 JAISTからプレス発表)などの光がん療法を開発している。
【用語解説】
*1 近赤外レーザー光
レーザーとは、光を増幅して放射するレーザー装置、またはその光のことである。レーザー光は指向性や収束性に優れており、発生する光の波長を一定に保つことができる。とくに700~1100 nmの近赤外領域の波長の光は生体透過性が高いことが知られている。
*2 紅色光合成細菌
近赤外光を利用して光合成を行う細菌。水の分解による酸素発生は行わない。
令和3年2月16日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2021/02/16-1.html

