芳坂貴弘 教授


東京工業大学工学博士。岡山大学工学部助手を経て2003年に本学助教授に就任。2009年より現職。専門は拡張遺伝子工学。![]()
![]()
拡張遺伝暗号「4塩基コドン」によって非天然アミノ酸を導入することで、全く新しい機能を持ったタンパク質を創製する研究に取り組んでいるマテリアルサイエンス研究科の芳坂貴弘教授。芳坂教授の研究成果は、タンパク質の観察や検出を容易にするなど、従来の研究方法を大きく変える基盤技術として注目されているほか、病気の診断・治療など医療分野への応用が期待されています。
生物の「潜在能力」を引き出す
私たちが研究対象としているのはタンパク質です。人間がもともと生物が持っているタンパク質を、そのままの形で、あるいは手を加えて性能をよくして産業や医療に応用しています。
通常のタンパク質の合成では、3つの核酸塩基の並び(コドン)が、ひとつのアミノ酸に翻訳されます。この過程で、生物が使用するアミノ酸は天然に存在する20種類に限られています。私はここにもうひとつ核酸塩基をつけて、4つの核酸塩基が並ぶ「4塩基コドン」に拡張させ、天然にはない新たなアミノ酸に対応させることに成功しました。さらにその非天然アミノ酸をねらった位置に組み込むことで、新しい機能を持ったタンパク質を合成することにも成功しています。たとえるなら、今まで20ピースしかなかったブロックに新たなブロックを加えるようなものです。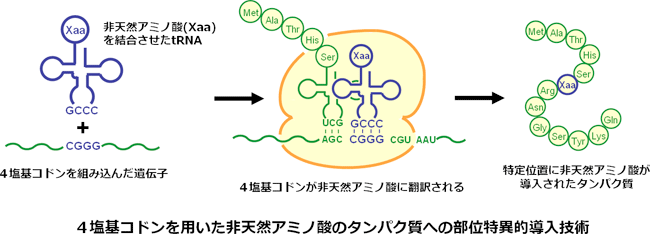
そもそもこうした研究は、約20年前、生物が持っているある潜在能力に着目したことに始まります。実は自然界においても、突然変異によって4塩基コドンをアミノ酸に翻訳する微生物がいることが分かっていました。従来は「生物はそんな意外なことができるんだ」で終わっていたのですが、私はこの生物の潜在能力をテクノロジーとして人間の役に立つように活用したいと思ったのです。
具体的には4塩基コドンの技術によって、蛍光標識をつけたタンパク質や、通常より高い活性を持つタンパク質など、これまで自然界には存在しないタンパク質を人工的に作り出すことが可能になりました。光る非天然アミノ酸をタンパク質に組み込めば、タンパク質が生体内のどこでどのような働きをしているのかを容易に調べることができます。
非天然アミノ酸をタンパク質に組み込む技術は、バイオベンチャーとの連携で2008年に試薬キットとして製品化・市販され、さまざまな研究室で使ってもらえるようになっています。

さまざまな分子を高感度に、迅速に検出する技術を開発
2011年にはこうした技術をもとに「抗原に結合すると光る抗体」の作製に成功しています。通常は、抗体そのものに含まれるアミノ酸(トリプトファン:Trp)によって蛍光は消されていますが、抗原と結合すると光るようになるという原理で、ターゲットとなるさまざまな分子を高感度に、迅速に検出するシステムの開発につなげようというものです。
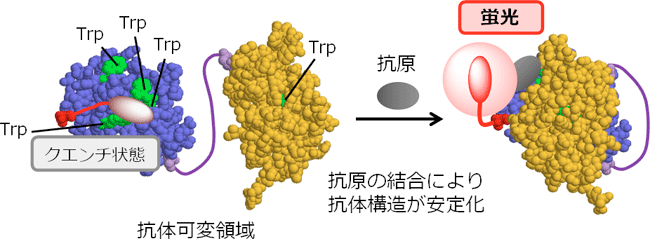 抗原に結合すると光る抗体
抗原に結合すると光る抗体
実際この方法で、骨粗鬆症などのマーカー分子であるオステオカルシン、内分泌攪乱作用が懸念されるビスフェノールA、モルヒネ・ヘロイン類などの低分子、リゾチームや血清アルブミンのようなタンパク質など、多くの抗原を混ぜるだけで高感度に定量できることが分かっています。
2012年10月には、この技術をもとに共同研究企業が、不正薬物をその場で検知できるオンサイト微量分析キットの開発を完了しました。これは採取した試料を試薬の入ったセルに入れて装置にセットするだけで90秒以内にナノグラムレベルの抗原の有無が判定できるという画期的なシステムで、2013年1月から財務省を通じ税関における不正薬物検知用として試験導入することが決定しています。
不正薬物の検知システムは、研究の病気の診断や治療薬への展開を指向していた私にとって意外な応用でしたが、実用化を進める過程をサポートすることによって新たな発見もありました。これを研究室にフィードバックし、また次に社会への貢献につなげるという理想的な循環が生まれていることを感じています。
抗原に結合すると光る抗体をつくるという基本的な技術に関しては、試料に応じた蛍光標識試薬を使用することで、感染症などの臨床検査分野、抗がん剤などの血中濃度をモニタリングする医療分野への展開も期待されています。抗がん剤は同じ量を投与しても、患者さんの体質によってすぐに代謝されて効果を発揮しなかったり、逆に多く残って副作用が激しかったりと、個人差が大きいものです。私たちの技術を活かせば、患者さんのベッドサイドで迅速に抗がん剤の血中濃度を測定することができるようになり、がん治療に大いに貢献できると信じています。
病気の診断から治療へ
研究室では病気の診断ということから一歩踏み出して、治療への応用に関する研究にも取り組んでいます。これは生体内で安定して機能を発揮するタンパク質薬剤の開発に向けた研究で、具体的にはC型肝炎の治療に使われるインターフェロンなどを対象にしています。
一般に、タンパク質を薬として注射した場合、体内で分解・排出されやすく、連日の投与が欠かせません。一方、高分子(ポリエチレングリコール)を修飾することで、分解排出を抑制することができますが、従来の技術では修飾する部位は制御できていませんでした。そのために、付く場所によってはタンパク質の活性を妨げてしまうこともあります。そこで私たちはタンパク質に特殊な反応性を有する非天然アミノ酸をあらかじめ付けておき、そこにポリエチレングリコールを化学修飾するという方法を模索し、最近プロトタイプの完成に漕ぎつけています。
研究のモチベーション
研究者にとって研究に取り組むモチベーションには二つの側面があると思います。私自身は、4塩基コドンに取り組んでいたころは、単純に今までできなかったことができるようになるという面白みを求めて研究に没頭していました。現在はというと少し価値観が変わって、研究を通じて社会の役に立ちたいという信念があります。
世の中の役に立つためには、現在ある課題を解決してできなかったことをできるようにしなければなりません。その繰り返しによって、はじめて役に立つ技術が生まれます。これこそが研究の醍醐味です。学生にもこの醍醐味を味わってほしいですね。

平成24年11月掲載

