研究活動の検索
研究概要(研究室ガイド)やプレスリリース・受賞・イベント情報など、マテリアルサイエンスの研究室により公開された情報の中から、興味のある情報をタグや検索機能を使って探すことができます。糖鎖による抗体ダイナミクスの制御機構を解明 ~分子経絡が抗体医薬設計の新たな鍵に~
  |
| 大学共同利用機関法人 国立大学法人 東京科学大学 公立大学法人 名古屋市立大学 ⼀般財団法人 国立大学法人 大阪大学 国立大学法人 |
糖鎖による抗体ダイナミクスの制御機構を解明
~分子経絡が抗体医薬設計の新たな鍵に~
自然科学研究機構(生命創成探究センター)の谷中冴子 准教授(現 東京科学大学 准教授)、加藤晃⼀ 教授(生命創成探究センター、名古屋市立大学)らは、抗体の糖鎖修飾、特にガラクトース付加が、抗体分子の構造と動態に及ぼす影響を原子レベルで解明しました。
本研究の成果は、国際科学雑誌 「Proceedings of the National Academy of Sciences of the United States of America(米国科学アカデミー紀要)」に掲載予定です。論文は日本時間2025年8月5日の週にオンライン公開される予定であり、DOIおよび掲載URLは公開後に付与されます。
【発表のポイント】
私たちの体には、病原体から身を守るための免疫システムが備わっています。その中心的な役割を担うのが「免疫グロブリンG(IgG)」注1) と呼ばれる抗体です。IgGは、特定の抗原を認識して結合するだけでなく、Fc受容体や補体といったエフェクター分子との相互作用を通じて、様々な免疫応答を誘導します。本研究では、IgGのFc領域 注2) に結合した「糖鎖」の修飾が、IgGの動的な構造変化を制御し、その結果として免疫機能が調節されるメカニズムを、計算科学と実験科学を融合したアプローチで明らかにしました。特に、本研究では、糖鎖修飾による影響が、あたかも私達の体の中に張り巡らされた経絡のように、分子レベルで伝播していく「分子経絡」注3) の重要性に着目しました。
【研究の背景】
治療用抗体は、がんや自⼰免疫疾患など、さまざまな疾患の治療に用いられています。抗体の効果は、標的抗原への結合だけでなく、Fc領域を介したエフェクター機能 注4) の発揮によっても大きく左右されます。Fc領域の糖鎖修飾 注5) は、抗体のエフェクター機能を調節する重要な因子であり、そのメカニズム解明は、より効果的な抗体医薬品の開発につながると考えられています。
【本研究の手法と成果】
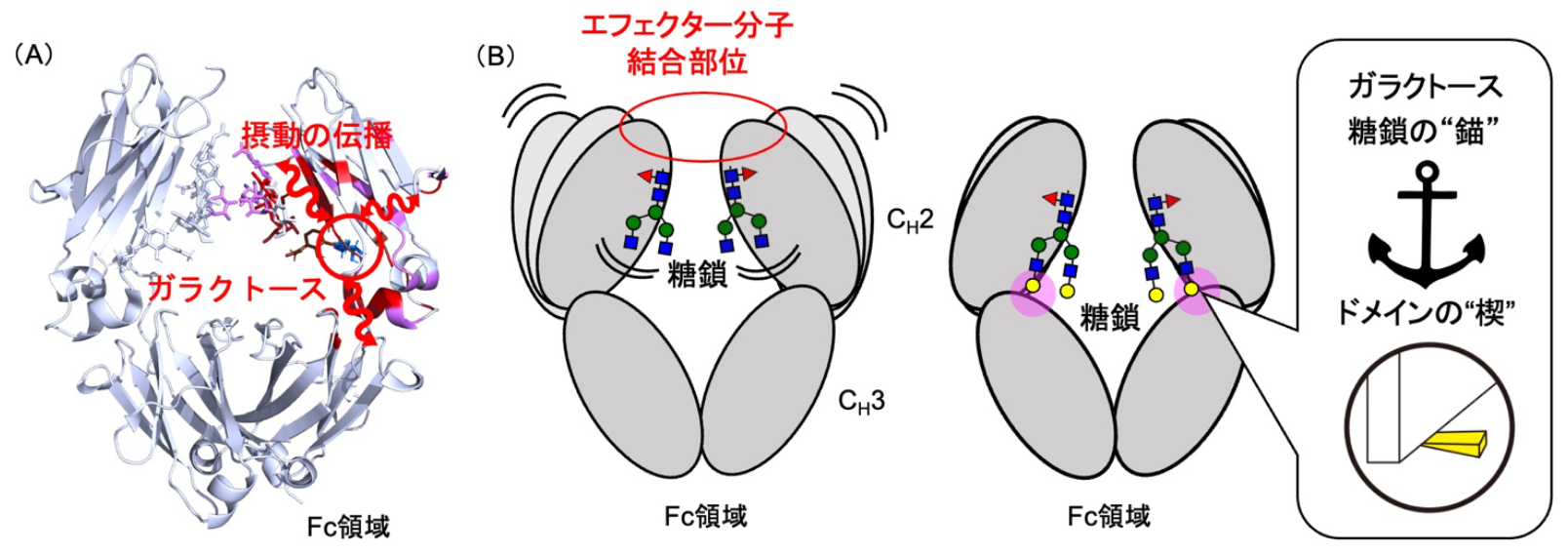
研究グループは、遺伝子工学的手法と酵素反応を組み合わせることで、糖鎖構造が異なるIgG1-Fcを調製しました。これらについて、安定同位体標識NMR分光法 注6) を用いてFc領域の動的構造を解析するとともに、分子動力学シミュレーション 注7) によって糖鎖修飾がFc領域のコンフォメーション変化に与える影響を評価しました。また、動的ネットワーク解析を用いて、「分子経絡」を同定しました。NMR分光法と分子動力学シミュレーションの結果から、ガラクトース 注8) 残基は糖鎖の動きを止める「錨」およびFc領域全体の動きを抑える「楔」としてはたらき、フコース 注9) 除去は特定のFc受容体との結合に関与するアミノ酸残基の動態を変化させることが明らかになりました。これらの結果は、糖鎖修飾がIgGのFc領域の動的構造を制御し、エフェクター機能を調節するメカニズムを原子レベルで理解する上で重要な知見となります。特に、「分子経絡」の存在は、糖鎖修飾の効果がFc領域全体に伝播する様子を示唆しています。

| (図)(A)糖鎖のガラクトース残基での構造変化がFc分子内を伝わる様子を示している。(B)ガラクトース残基は糖鎖(黄色の丸)の動きを止める「錨」およびFc領域全体の動きを抑える「楔」としてはたらき、エフェクター分子との相互作用を助けている。 |
【成果の意義および今後の展開】
本研究成果は、治療用抗体の開発において、Fc領域の糖鎖修飾を最適化するための合理的な設計基盤を提供します。今後は、糖鎖修飾と抗体の構造・機能相関に関するさらなる研究を進めることで、また「分子経絡」の操作という新たな視点を取り入れることで、より効果的かつ安全な抗体医薬品の開発に貢献できると期待されます。
【用語解説】
【論文情報】
| 掲載誌 | Proceedings of the National Academy of Sciences of the United States of America |
| タイトル | Exploring Glycoform-Dependent Dynamic Modulations in Human Immunoglobulin G via Computational and Experimental Approaches |
| 著者 | Saeko Yanaka, Yoshitake Sakae, Yohei Miyanoiri, Takumi Yamaguchi, Yukiko Isono, Sachiko Kondo, Miyuki Iwasaki, Masayoshi Onitsuka, Hirokazu Yagi, Koichi Kato*(*責任著者) |
| DOI | |
| 掲載日 |
【著者情報】
東京科学大学 総合研究院 フロンティア材料研究所)
名古屋市立大学大学院薬学研究科)
【研究サポート】
本研究は、文部科学省科学研究費助成事業(JP20K15981 および JP23K24018 谷中冴子、JP19H01017 および JP24H00599 加藤晃⼀)、日本医療研究開発機構(AMED)(JP21ae0121020 および JP23ak0101209 谷中冴子、JP21ae0121013 加藤晃⼀)、文部科学省研究大学総合研究育成事業:研 究大学強化促進事業(CURE)課題番号JPMXP1323015488(Spin-LプログラムNo. spin24XN014)、生命創成探究センター共同利用研究(24EXC901、25EXC603)、および科学技術振興機構(JST)戦略的 創造研究推進事業(CREST)(JPMJCR21E3 加藤晃⼀)の助成を受けたものです。また、本研究は文部 科学省ナノテクノロジープラットフォーム事業(分子・物質合成)、大阪大学蛋白質研究所共同利用・共 同研究拠点 NMRCR-16-05, 17-05, 18-05, 19-05, 20-05, 21-05、計算科学研究センター(24-IMS-C197)、文部科学省先端研究設備共用促進事業(コアファシリティ構築支援プログラム)JPMXS0441500024、国際・産学連携インヴァースイノベーション材料創出(DEJI2MA)プロジェクト、およびヒューマングライコームプロジェクトの支援を受けて行われました。
令和7年8月5日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2025/08/05-1.htmlがんを欺くためのがん細胞の顔をしたナノ粒子の開発に成功 -マウス体内のがんを高感度検出・効果的治療が可能に!-

がんを欺くためのがん細胞の顔をしたナノ粒子の開発に成功
-マウス体内のがんを高感度検出・効果的治療が可能に!-
【ポイント】
- カーボンナノホーンにがん細胞成分と抗がん剤を吸着させた複合体の作製に成功
- 当該ナノ粒子の高い血中滞留性、腫瘍内浸潤作用、EPR効果により腫瘍に集積し、マウスに移植したがんの可視化と、免疫賦活化作用、抗がん作用、光熱変換によるがん治療が可能であることを実証
- 当該ナノ粒子と近赤外光を組み合わせた新たながん診断・治療技術の創出に期待
| 北陸先端科学技術大学院大学(学長・寺野 稔、石川県能美市)物質化学フロンティア研究領域の都 英次郎准教授らは、カーボンナノホーン*1表面にがん細胞成分と抗がん剤を被覆したナノ粒子の作製に成功した(図1)。得られたナノ粒子は、ナノ粒子特有のEPR効果*2のみならず、がん細胞成分に由来する血中滞留性、腫瘍標的能によって、大腸がんを移植したマウス体内の腫瘍内に効果的に集積し、がん細胞成分に由来する免疫賦活化効果と抗がん剤に由来する薬効に加え、生体透過性の高い近赤外レーザー光*3により、がん患部の可視化と光熱変換による多次元的な治療が可能であることを実証した。さらに、マウスを用いた生体適合性試験などを行い、いずれの検査からもナノ粒子が生体に与える影響は極めて少ないことがわかった。当該ナノ粒子と近赤外レーザー光を組み合わせた新たながん診断・治療技術の創出が期待される。 |
【研究背景と内容】
ナノ炭素材料の一つであるカーボンナノホーン(CNH)は、高い生体適合性と優れた物理化学的特性を有することが知られており、とりわけバイオメディカル分野で大きな注目を集めている。都准教授は、CNHが生体透過性の高い波長領域(650~1100 nm)のレーザー光により容易に発熱する特性(光発熱特性)を世界に先駆けて発見し、当該光発熱特性を活用したがん診断・治療技術の開発を推進している[例えば、Nature Communications 11, 4117 (2020).]。
CNHは、そのまま水などに分散させようとすると、分子間の強い相互作用により、粒状に凝集してしまう。CNHの光発熱特性を発揮させるためには、この凝集状態を解消しCNHを溶媒中にナノレベルで分散させる必要がある。従来法としては、ポリエチレングリコール(PEG)などの水溶性ポリマーをCNH表面に化学的に被覆することで水中分散性を改善させる手法がある。しかし、PEG修飾したナノ粒子を繰り返し投与した際、2回目投与時において、従来の高い血中滞留性が損なわれ、血中から速やかに消失するという現象[Accelerated blood clearance(ABC)現象]が報告されているだけでなく、PEGそのものが重篤なアレルギー反応を引き起こす可能性があるため、代替材料の開発が急務となっている。
がん細胞は、免疫細胞からの攻撃回避のために特殊な細胞膜機能を有している。また、堅牢な腫瘍構造を維持するために、がん細胞同士の癒着・親和性を高めることが可能となる特別な細胞膜成分で構成されている。さらに、がん細胞内の構成成分(遺伝子やタンパク質など)には免疫活性を高める効果があることが知られている。そこで本研究グループは、これらのがん細胞成分(細胞膜、遺伝子、タンパク質など)をCNHに搭載することができれば、CNHのマウス体内における血中滞留性、腫瘍内浸潤性、免疫活性などを高めることができるのではないかと考え、研究をスタートさせた。より具体的には、がん細胞成分と抗がん剤を被覆したCNHをがん患部に同時に送り込むことで、がん細胞成分に由来する上記の血中滞留効果、腫瘍内浸潤作用、免疫賦活化能に加え、抗がん剤に由来する薬効と共に、生体透過性の高い近赤外レーザー光を用いることで、患部の可視化やCNHに由来する光熱変換を利用した、新たながんの診断や治療の実現を目指した。
当該目標を達成するために、今回開発した技術では、簡便な超音波照射によってがん細胞成分をCNH表面に吸着させることで、CNHを水溶液中に分散できるようにした。また、がん細胞成分を活用することで、水に不溶な抗がん剤[パクリタキセル(PTX)]もCNH表面に同時に被覆することに成功した(図1)。この方法で作製したがん細胞成分-PTX-CNH複合体は、30日以上の粒径安定性を有していること、細胞に対し高い膜浸透性を有し抗がん作用を発現すること、近赤外レーザー光照射により発熱が起こることが確認できたため、がん患部の可視化と治療効果について試験を行った。なお、がん患部の可視化には、がん診断に利用可能な近赤外蛍光色素[インドシアニングリーン(ICG)]をがん細胞成分と共にCNH表面に結合させたナノ粒子(がん細胞成分-ICG-CNH複合体)を利用した。
大腸がんを移植して約10日後のマウスに、当該がん細胞成分-ICG-PTX-CNH複合体を尾静脈から投与し、24時間後に740~790 nmの近赤外光を当てたところ、がん患部が蛍光を発している画像が得られた(図2A)。また、当該ナノ粒子が、非イオン性のポリエトキシ化界面活性剤(クレモフォールEL)で被覆した従来型の水溶性ポリマーで被覆したCNH(CRE-ICG-CNH複合体)に比較して、がん組織に効果的に取り込まれていることが分かった(図2A)。そこで、当該ナノ粒子(がん細胞成分-PTX-CNH複合体)が集積した患部に対して808 nmの近赤外レーザー光を照射したところ、がん細胞成分に由来する血中滞留効果、腫瘍内浸潤作用、免疫賦活化能と抗がん剤に由来する薬効に加え、CNHの光熱変換による効果で2日後には、がんを完全に消失させることに成功した(図2B)。
一方、腫瘍内における薬効メカニズムを組織学的評価により調査したところ、とりわけレーザー照射したがん細胞成分-PTX-CNH複合体において細胞障害性の高いT細胞やナチュラルキラー細胞などの免疫細胞が活性化されていることが明らかとなった。
さらに、がん細胞成分-PTX-CNH複合体をマウスの静脈から投与し、生体適合性を血液検査(1週間調査)と体重測定(約1ヵ月調査)により評価したが、いずれの項目でもがん細胞成分-PTX-CNH複合体が生体に与える影響は極めて少ないことがわかった。
これらの成果は、今回開発したがん細胞成分のナノ粒子コーティング技術が、革新的がん診断・治療法の基礎に成り得ることを示すだけでなく、ナノテクノロジーや光学といった幅広い研究領域における材料設計の技術基盤として貢献することを十分期待させるものである。
本成果は、2024年8月19日に生物・化学系のトップジャーナル「Small Science」誌(Wiley発行)のオンライン版に掲載された。なお、本研究は、文部科学省科研費 基盤研究(A)(23H00551)、文部科学省科研費 挑戦的研究(開拓)(22K18440)、国立研究開発法人科学技術振興機構(JST) 研究成果最適展開支援プログラム (A-STEP)(JPMJTR22U1)、公益財団法人発酵研究所、公益財団法人上原記念生命科学財団、ならびに本学超越バイオメディカルDX研究拠点、本学生体機能・感覚研究センターの支援のもと行われたものである。
 図1.がん細胞成分を被覆したナノ粒子の作製と本研究の概念。
図1.がん細胞成分を被覆したナノ粒子の作製と本研究の概念。
CNH: カーボンナノホーン、PTX: パクリタキセル。
 図2. ナノ粒子をがん患部に集積・可視化(A)し、光照射によりがんを治療(B)
図2. ナノ粒子をがん患部に集積・可視化(A)し、光照射によりがんを治療(B)
(赤色の囲いは腫瘍の位置を示している)。
【論文情報】
| 掲載誌 | Small Science |
| 論文題目 | Biomimetic functional nanocomplexes for photothermal cancer chemo-immunotheranostics |
| 著者 | Nina Sang, Yun Qi, Shun Nishimura, Eijiro Miyako* |
| 掲載日 | 2024年8月19日にオンライン版に掲載 |
| DOI | 10.1002/smsc.202400324 |
【用語説明】
飯島澄男博士らのグループが1998年に発見したカーボンナノチューブの一種。直径は2~5 nm、長さ40~50 nmで不規則な形状を持つ。数千本が寄り集まって直径100 nm程度の球形集合体を形成している。とりわけ、薬品の輸送用担体として期待されており、バイオメディカル分野で注目を集めている。
100 nm以下のサイズに粒径が制御された微粒子は、正常組織へは漏れ出さず、腫瘍血管からのみ、がん組織に到達して患部に集積させることが可能である。これをEPR効果(Enhanced Permeation and Retention Effect)という。
レーザーとは、光を増幅して放射するレーザー装置、またはその光のことである。レーザー光は指向性や収束性に優れており、発生する光の波長を一定に保つことができる。とくに700~1100 nmの近赤外領域の波長の光は生体透過性が高いことが知られている。
令和6年8月22日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2024/08/22-1.html生きたままの細胞の微細構造に迫る ~再生医療、創薬分野における研究・開発の発展に貢献~

  |
株式会社 東レリサーチセンター 国立大学法人 |
生きたままの細胞の微細構造に迫る
~再生医療、創薬分野における研究・開発の発展に貢献~
| 株式会社東レリサーチセンター(所在地:東京都中央区日本橋本町一丁目1番1号、社長:吉川正信、以下「TRC」)は、国立大学法人北陸先端科学技術大学院大学(所在地:石川県能美市旭台一丁目1番地、学長:寺野稔)物質化学フロンティア研究領域の松村和明教授と共同で、生きている細胞の微細な構造を解析する新しい方法を開発しました。 細胞は、細胞膜や細胞質、細胞小器官などさまざまな部分から成り立っています。これらの構造を「細胞の微細構造」と呼び、細胞のさまざまな機能を発現するために重要な役割を果たしています。細胞の微細構造は非常に小さく、通常は電子顕微鏡1)や超解像蛍光顕微鏡2)を用いて観察します。TRCと松村和明教授の研究チーム(以下、「研究チーム」)は、小角X線散乱3)を用いて、ナノメートルスケール(1億分の1メートル)のレベルで細胞の微細構造を解析する新しい方法を開発しました。この方法は、低温など特殊な環境での観察も可能で、新たな細胞の微細構造の観察法として期待されます。また、近年注目されている「相分離生物学」4)では、細胞内のタンパク質や核酸の凝集や分散などの相分離現象が、細胞の柔軟な機能発現に重要な役割を果たしているとされています。今回用いた小角X線散乱では、相分離構造を高感度で観測することができ、細胞生物学や再生医療の発展に貢献することが期待されます。 この研究成果は、2024年7月8日公開のBiophysical Chemistry誌に掲載されました。また、この研究は北陸先端科学技術大学院大学の超越バイオメディカルDX研究拠点の支援を受けて行われました。 |
【背景】
細胞の周りの環境(例えば浸透圧)が変わると、細胞の大きさが変わることはよく知られています。しかし、それだけでなく、細胞膜の張力や細胞内のタンパク質の集まり方も影響を受けます。このような変化は、新規モダリティ医薬品5)の開発や再生医療の分野で重要な知見となっています。
従来、細胞の微細構造の観察は電子顕微鏡や超解像蛍光顕微鏡によって行われてきました。しかし、電子顕微鏡では、煩雑な前処理や真空下での観察のため、生きたままの細胞の観察は難しく、また、蛍光顕微鏡では、解像度はサブマイクロメートル程度であり、微細構造の観察が難しい場合があります。したがって、さまざまな環境で生きたまま、かつ、非常に小さなスケールで細胞の微細構造を観察する新しい方法が求められています。
【研究の概要】
これに対して研究チームは、大型放射光施設SPring-8のBL08B2ビームライン6)で、小角X線散乱を用いて細胞の微細構造の解析を行いました。その結果、細胞内のさまざまな構造からの信号が検出され、それらが環境の変化に敏感に反応していることがわかりました。例えば、タンパク質を作るリボソームは、低浸透圧(水分が多い)ではサイズが膨張しますが、高浸透圧ではリボソームのサイズが収縮し、リボソーム間の距離が近づく様子が観察されました。また、高浸透圧下では、細胞膜が折りたたまれてマルチラメラ構造を作ることや、タンパク質や核酸の凝集状態が変化することが明らかになりました(図1)。これらの結果は、タンパク質の生成や放出に関連する現象と考えられます。抗体タンパク質の品質や産生量と細胞の微細構造の関係性が明らかになることで、抗体医薬品の開発への貢献が期待されています。

図1. 細胞の小角X線散乱信号の浸透圧に対する変化。高浸透圧で特に明瞭な散乱信号が検出され、さまざまな細胞微細構造の変化が起こっている。
【今後の展開】
細胞の微細構造の解明は、創薬や再生医療などの分野で注目されています。細胞の機能(抗体産生や接着・増殖・分化など)を最適化するために、さまざまな環境で細胞の微細構造を詳細に解明することが重要です。今回開発した小角X線散乱による細胞の微細構造解析法は、従来の電子顕微鏡や蛍光顕微鏡の限界を補完し、これまで観察が難しかった不定な構造(相分離)の観察にも有効です。また、従来の顕微鏡観察では困難であった低温や高温などの環境でも構造変化を捉えることが可能です。特に低温環境での細胞の微細構造解析は、細胞や組織の凍結保存への応用が可能であり、新型コロナウイルスで注目されたワクチンの凍結保存技術の発展にも寄与が期待されます。これらの技術は、食料不足や移植医療、創薬分野の課題解決や研究・技術開発への貢献が期待されています。
【用語説明】
試料に電子線を照射し、反射あるいは透過電子像を得る方法。ナノメートルスケールの細胞小器官の形態観察が可能であるが、煩雑な前処理や真空下での観察のため、生きたままの細胞を観察することは不可能である。
特定のタンパク質を蛍光分子で標識することで、その対象物を明るく輝かせ、可視光の波長の限界を超えた分子レベルの解像度で細胞を観察できる方法。ただし、蛍光標識した対象が凝集している場合などは、可視光の限界を超えて見分けることはできない。また、蛍光分子の選択は困難なこともあり、観察環境での蛍光活性の確認も必要である。
X線を物質に照射したときに生じる散乱を観測する方法。X線の散乱は物質中の分子の並び方によって異なる散乱を起こし、物質のナノメートル(10億分の1メートル)スケールの構造を調べることができる。
細胞内で起こるタンパク質や核酸などの生体分子の相分離に関する生物学分野の一つ。生体分子の相分離によって膜のない細胞小器官が形成されることで、細胞の外部環境の変化に瞬時に応答していると考えられている。細胞内の相分離現象が、細胞内の化学反応やシグナル伝達に重要な役割を果たしている可能性があり、新たな生物学として近年注目を集めている。
従来の低分子化合物を用いた医薬品とは異なる仕組みで作用する医薬品。従来の医薬品では効果が限定された疾患や患者に対して、新たな治療法を提供できる可能性があり、近年、研究・技術開発が進められている。生物由来の抗体や核酸、遺伝子、細胞医薬品などが該当する。
SPring-8 は兵庫県の播磨科学公園都市にある世界最高輝度の放射光を生み出す理化学研究所の施設。SPring-8 では、この放射光を用いて、物質科学や生命科学などの幅広い研究が行われている。BL08B2ビームラインは兵庫県が設置したビームラインであり、放射光の産業利用支援を目的としている。
【掲載論文】
| 掲載誌 | Biophysical Chemistry, 312 (2024) 107287. |
| 論文題目 | Nanoscale intracellular ultrastructures affected by osmotic pressure using small-angle X-ray scattering |
| 著者 | Masaru Nakada, Junko Kanda, Hironobu Uchiyama, Kazuaki Matsumura |
| DOI | https://doi.org/10.1016/j.bpc.2024.107287 |
| 公表日 | 2024年7月8日(オンライン公開) |
令和6年7月10日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2024/07/10-1.htmlがん治療のための多機能性アミノ酸ナノ粒子の開発に成功

  |
国立大学法人 フランス国立科学研究センター |
がん治療のための多機能性アミノ酸ナノ粒子の開発に成功
【ポイント】
- 3種類のペプチドと光開始剤が溶解した水溶液に紫外線を照射すると球状のナノ粒子が生成することを発見
- 合成したアミノ酸ナノ粒子に抗がん剤が封入可能であり、タンニン酸-鉄複合体をナノ粒子表面にコーティングできることを発見
- 多機能性アミノ酸ナノ粒子の複合的な分子設計によって生体内外の効果的ながん細胞死を誘導することに成功
北陸先端科学技術大学院大学(学長・寺野稔、石川県能美市)物質化学フロンティア研究領域の都英次郎准教授らはフランス国立科学研究センター(所長・アントワーヌ・プチ、フランス・パリ)のアルベルト・ビアンコ博士ら(同センター細胞分子生物学研究所、フランス・ストラスブール)と共同で、多機能性のアミノ酸*1から構成されるナノ粒子を活用した新しいがん治療技術の開発に成功した(図1)。
ペプチドやタンパク質の構成要素であるアミノ酸は、高い生体適合性を有するため、とりわけナノ粒子化したアミノ酸をバイオメディカル分野に応用する研究に大きな注目が集まっている。都准教授の研究チームでも、光を使った簡便な手法によりアミノ酸ナノ粒子を合成できれば、新しいがん治療技術が実現できるのではないかと考え、研究をスタートさせた。
研究チームは、N末端*2を9-フルオレニルメチルオキシカルボニル基(Fmoc)*3で保護した3種類のペプチド*4(Fmoc保護トリプトファン- Fmoc保護トリプトファン、Fmoc保護チロシン-Fmoc保護トリプトファン、Fmoc保護チロシン- Fmoc保護チロシン)と光開始剤(リボフラビン*5)が溶解した水溶液に紫外線*6を照射するとアミノ酸分子間における共有結合*7を介した光架橋*8と非共有結合*9を介した自己組織化現象*10が誘起され、約100 nmの直径の球状ナノ粒子が形成されることを見出した(図1)。また、合成したアミノ酸ナノ粒子は、抗がん剤(ドキソルビシン*11)が容易に封入可能であり、生体透過性の高い近赤外レーザー*12に応答して発熱するタンニン酸-鉄複合体*13をナノ粒子表面にコーティングできることも明らかとなった。さらに、研究チームは、細胞やマウスを用いた実験によって、これらの複合的な分子設計に基づいた多機能性アミノ酸ナノ粒子が効果的ながん光治療技術に応用可能であることを示した。
本成果は、2023年12月28日にWiley-VCH発行「Small」のオンライン版に掲載された。なお、本研究は、文部科学省科研費 基盤研究(A)(23H00551)、文部科学省科研費 挑戦的研究(開拓)(22K18440)、国立研究開発法人科学技術振興機構(JST) 研究成果最適展開支援プログラム (A-STEP)(JPMJTR22U1)、公益財団法人発酵研究所、公益財団法人上原記念生命科学財団、ならびに本学超越バイオメディカルDX研究拠点、本学生体機能・感覚研究センターの支援のもと行われたものである。
 図1. 多機能性アミノ酸ナノ粒子の構造
図1. 多機能性アミノ酸ナノ粒子の構造
【論文情報】
| 掲載誌 | Small (Wiley-VCH) |
| 論文題目 | Photocrosslinked co-assembled amino acid nanoparticles for controlled chemo/photothermal combined anticancer therapy |
| 著者 | Tengfei Wang, Yun Qi, Eijiro Miyako,* Alberto Bianco,* Cécilia Ménard-Moyon* |
| 掲載日 | 2023年12月28日にオンライン版に掲載 |
| DOI | 10.1002/smll.202307337 |
【用語説明】
アミノ基(-NH2)とカルボキシ基(-COOH)の両方を持つ有機化合物の総称。天然には約500種類のアミノ酸が見つかっており、そのうち22種類が、鎖状に多数連結(重合)して高分子を形成しタンパク質となる。ヒトのタンパク質は約20種類のアミノ酸から構成されている。
タンパク質またはペプチドにおいてフリーなアミノ基で終端している側の末端のこと。
有機合成で用いられる、アミノ基の保護基の1つ。Fmoc(エフモック)基と略される。
アミノ酸が結合したもの。アミノ酸とアミノ酸がペプチド結合(-CONH-)して、2個以上つながった構造のものをペプチドという。
光開始剤とは主に可視光や紫外光を吸収し、この光エネルギーをフリーラジカルに変換する化学物質のこと。リボフラビンは、紫外線の存在下、光還元反応によりフリーラジカルを生成する。この性質を利用して、分子間の架橋が可能となり、光開始剤として合成反応によく利用される。
波長が可視光よりも短い10nm~400nmの光。
原子同士の間で電子を共有することで生じる化学結合で、結合力が強い。
光で化学結合を形成することにより、分子中の特定原子間にできる三次元的な化学結合のこと。
共有結合以外の原子同士を結びつける力を表し、水素結合やπ-π(パイ-パイ)相互作用などが知られている。共有結合に比べて結合力は弱いが、複数の力が協同的に働くことで原子・分子はあたかも共有結合のように連結される。
分子や原子などの物質が自発的に秩序を持つ大きな構造を作り出す現象。
抗ガン剤の一種である。腫瘍細胞の核内の遺伝子に結合することで、DNAやRNAを合成する酵素の働きを阻害することで抗腫瘍効果を示す。
レーザーとは、光を増幅して放射するレーザー装置、またはその光のことである。レーザー光は指向性や収束性に優れており、発生する光の波長を一定に保つことができる。とくに700~1100 nmの近赤外領域の波長の光は生体透過性が高いことが知られている。
タンニン酸はタンパク質を変性させることにより組織や血管を縮める作用を有する渋味を示す化学物質。鉄イオンと反応し強く結合して難溶性の塩(タンニン酸-鉄複合体)を形成することが知られている。
令和6年1月9日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2024/01/09-1.html海洋細菌による新しいがん免疫療法の開発に成功! ~遺伝子改変不要の天然細菌が大腸がんを選択的に攻撃~
海洋細菌による新しいがん免疫療法の開発に成功!
~遺伝子改変不要の天然細菌が大腸がんを選択的に攻撃~
【ポイント】
- 海洋細菌Photobacterium angustumが大腸がんに対して強力な抗腫瘍効果を示すことを世界で初めて発見
- 遺伝子改変を一切行わない天然細菌でありながら、がん組織に選択的に集積し、健康な臓器への影響が極めて少ない
- 細菌による直接的ながん細胞破壊と免疫系の活性化という二つのメカニズムで腫瘍を攻撃
- 従来の細菌療法と比較して優れた治療効果と安全性を確認
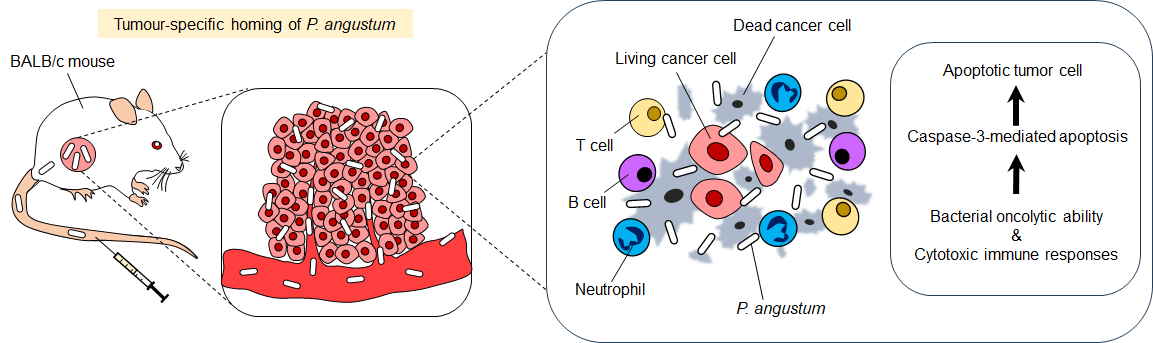
| 北陸先端科学技術大学院大学 物質化学フロンティア研究領域の都 英次郎教授と宮原 弥夏子大学院生(博士後期課程、JAIST SPRING研究員)らの研究チームは、海洋細菌*1Photobacterium angustum(フォトバクテリウム・アングスタム)が大腸がんに対して顕著な治療効果を示すことを発見しました。 本研究では、複数の海洋細菌株をスクリーニングした結果、P. angustumが遺伝子改変を施さない天然の状態で、がん組織に選択的に集積し、直接的な腫瘍溶解作用と強力な免疫活性化を引き起こすことを明らかにしました。マウスモデルにおいて、静脈内投与されたP. angustumは腫瘍組織に高度に集積する一方、肝臓を除く重要臓器への定着はほとんど認められず、血液学的異常や組織学的毒性も観察されませんでした。 さらに、P. angustumによる治療は、T細胞、B細胞、好中球などの免疫細胞の腫瘍内浸潤を促進し、腫瘍壊死因子α(TNF-α)やインターフェロンγ(IFN-γ)などの炎症性サイトカイン*2の産生を増強しました。また、細菌が産生する天然の外毒素*3により、がん細胞を直接破壊する能力も確認されました。これらの複合的な作用により、治療を受けたマウスの生存期間が著しく延長し、一部の個体では完全寛解が達成されました。 本研究成果は、遺伝子組み換え生物(GMO)*4に依存しない、より安全で生体適合性の高い新しいがん免疫療法の開発につながる重要な知見です。 この研究の詳細は、がん免疫療法分野の国際的トップジャーナルである「Journal for ImmunoTherapy of Cancer」に掲載されました。 |
【研究背景と内容】
がんは世界的な死因の上位を占めており、免疫チェックポイント阻害剤やCAR-T細胞療法などの画期的な免疫療法が開発されてきました。しかし、これらの治療法は高額であり、免疫関連の副作用、固形腫瘍における限定的な効果、腫瘍微小環境*5における免疫抑制機構などの課題があります。
細菌を用いたがん治療は150年以上前から検討されてきましたが、近年、特定の細菌種が腫瘍の低酸素環境や免疫抑制環境に選択的に定着し増殖する能力を持つことが明らかになり、注目を集めています。しかし、これまでの研究の多くは遺伝子改変された大腸菌やサルモネラ菌を用いており、安全性の懸念、複雑な製造プロセス、厳格な規制などの課題がありました。
本研究では、遺伝子改変を行わない天然の海洋細菌に着目し、がん治療への応用可能性を探索しました。
【研究の内容】
1. 海洋細菌のスクリーニング
研究グループは、P. angustum、P. phosphoreum、P. aquimaris、A. logei、P. indicumを含む複数の海洋細菌株について、大腸がんマウスモデルにおける抗腫瘍活性を評価しました。その結果、P. angustumのみが顕著な抗腫瘍効果を示し(図1)、生存期間を著しく延長させました。他の細菌株は高い毒性により投与後2日以内にマウスが死亡しました。
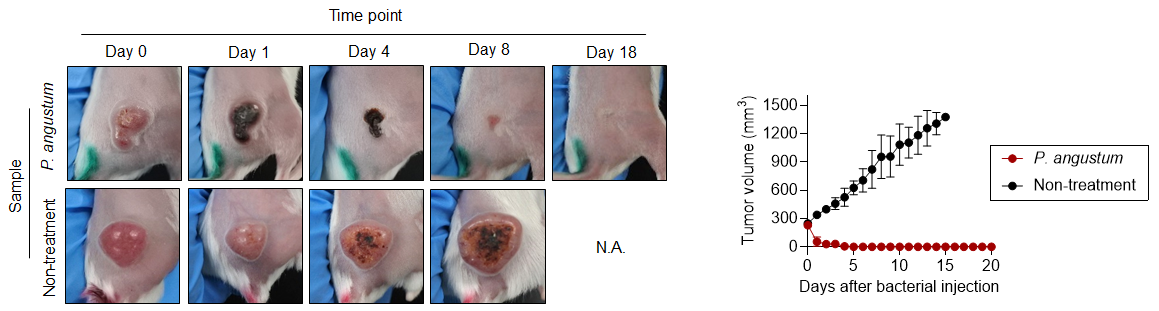
図1. 大腸がんマウスモデルにおけるP. angustumの抗腫瘍活性
2. 優れた安全性プロファイル
P. angustum投与後のマウスにおいて、体重減少や血液学的異常は認められませんでした。完全血球計算、生化学的分析、組織学的検査のいずれにおいても、毒性の徴候は観察されませんでした。また、炎症性サイトカインの上昇は毒性株と比較して顕著に低く、24時間後には肝臓を除く重要臓器から細菌が検出されませんでした。
3. 高い腫瘍選択性
静脈内投与されたP. angustumは、腫瘍組織に選択的に集積し、多数のコロニー形成が確認されました。一方、心臓、肺、腎臓、脾臓などの健康な臓器への定着はほとんど認められませんでした。
4. 二重の抗腫瘍メカニズム
P. angustumの抗腫瘍効果は、以下の二つのメカニズムによるものと考えられます(図2):
- 直接的な腫瘍溶解作用:細菌が産生する天然の外毒素(ヘモリシンなど)により、がん細胞を直接破壊
- 免疫系の活性化:T細胞、B細胞、好中球の腫瘍内浸潤を促進し、TNF-αやIFN-γなどの炎症性サイトカインの産生を増強

図2. P. angustumによる抗腫瘍メカニズム
5. 幅広い適用可能性
P. angustumは、炎症誘発性の大腸がんモデルに加え、薬剤耐性のトリプルネガティブ乳がんモデルにおいても顕著な抗腫瘍効果を示しました。これは、本治療法が大腸がん以外のがん種にも応用できる可能性を示唆しています。
【研究の意義と今後の展望】
本研究は、遺伝子改変を必要としない天然細菌が、安全かつ効果的ながん免疫療法として機能することを実証しました。今後は、さまざまながん種での有効性の検証、免疫チェックポイント阻害剤との併用効果の評価、長期的な免疫記憶の詳細な解析などを進める予定です。
また、P. angustumの腫瘍選択的な定着メカニズムや免疫活性化の分子機構をさらに解明することで、より効果的な治療法の開発につながることが期待されます。
本研究成果は、GMOに依存しない生体適合性の高い細菌療法という新しい治療パラダイムを提示するものであり、将来的には臨床応用に向けた開発が期待されます。
【研究支援】
本研究は、以下の研究資金の支援を受けて実施されました:
日本学術振興会(JSPS)科学研究費助成事業 基盤研究(A)(課題番号:23H00551)
同 科学研究費助成事業 挑戦的研究(開拓)(課題番号:22K18440)
同 地域中核・特色ある研究大学強化促進事業(課題番号:JPJS00420230006)
科学技術振興機構(JST)共創の場形成支援プログラム(課題番号:JPMJSF2318)
同 次世代研究者挑戦的研究プログラム(SPRING)(課題番号:JPMJSP2102)
【論文情報】
| 掲載誌 | Journal for ImmunoTherapy of Cancer |
| 論文題目 | Systemic administration of Photobacterium angustum promotes antitumor immunity and direct tumor lysis in murine models of colorectal cancer |
| 著者 | Mikako Miyahara, Teruhisa Takizawa, Matomo Sakari, Eijiro Miyako* |
| 掲載日 | 2025年11月19日にオンライン版に掲載 |
| DOI | 10.1136/jitc-2025-012665 |
【用語説明】
海洋環境に生息する細菌の総称。本研究で使用したPhotobacterium angustumは、特殊な培養条件を必要とせず、通常の海洋培地で培養可能。
細胞間の情報伝達に関与するタンパク質。TNF-αやIFN-γは免疫応答を促進する炎症性サイトカイン。
細菌が体外に分泌する毒性物質。本研究では、P. angustumが産生する外毒素ががん細胞を直接破壊することが示された。
遺伝子工学的手法により遺伝子を改変した生物。本研究で使用したP. angustumは天然株であり、遺伝子改変は行っていない。
がん組織とその周辺の細胞、血管、免疫細胞、シグナル分子などから構成される環境。多くの場合、低酸素状態や免疫抑制状態にある。
令和7年11月21日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2025/11/21-1.htmlパターン形成:分割現象における「対称性の破れ」を実証

  |
北陸先端科学技術大学院大学 科学技術振興機構(JST) |
パターン形成:分割現象における「対称性の破れ」を実証
【ポイント】
- 水の蒸発によって現れるパターン形成「界面分割現象」の新たな特徴を発見
- ポリマー分散液の蒸発界面が複数に分割するとき、「対称性の破れ」が現れることを実証
- 生体組織など自然界に見られる非対称なパターン形成の理解に有用
| 北陸先端科学技術大学院大学(学長・寺野稔、石川県能美市)サスティナブルイノベーション研究領域のグエン チキムロク大学院生(博士後期課程)、桶葭興資准教授らは、ポリマーが水に分散した粘性流体から現れる散逸構造[用語解説1]「界面分割現象」において、対称性の破れ[用語解説2]を実証した。これまで、界面[用語解説3]で起こる幾何学変形が、時間とともにどう進んでいくかは、不明な点が多かった。今回、明確な境界条件のもと、確率統計を通した解析を進めた結果、分割時に現れる核の位置に、空間的な「対称性の破れ」が生じることが明らかになった。これは、生体組織など自然界に見られる非対称なパターン形成の理解に有用である。 |
【研究概要】
自然界には様々な幾何学パターンがあり、例えば雪の結晶の形は、気温と水蒸気の量で多様に変化する。また、乾燥環境は水の蒸発を引き起こし、生物であればその成長過程で非対称なパターンをつくる。これまで、この幾何学性や非対称性について、数理的な解釈がなされてきたものの、物理化学的実験に基づいた再現はなされてこなかった。一方、桶葭准教授らの研究グループはこれまでに、ポリマー水分散系の蒸発界面に着目し、散逸構造「界面分割現象」を報告してきた (※1)。これは、ポリマー水溶液などの粘性流体を明確な境界のある有限空間から乾燥環境下におくと、一つの蒸発界面が複数の界面に分割される幾何学化現象である。ここで、空間軸の一つを1ミリメートル程度の隙間にすることで毛管現象[用語解説4]の物理条件が制御された空間となる。さらに、一定温度下で水の蒸発を一方向になるよう設定すると、蒸発界面直下の濃密なポリマーの密度がゆらぎ、複数の特異的位置でポリマーが析出して界面分割する。具体的には、多糖[用語解説5]の水溶液を乾燥環境下におくと、まるで界面から芽が出るようにセンチメートル単位で多糖が析出し界面が複数に分割される。ここでは、ミクロ構造の秩序化と同時に、マクロなパターンが現れることが分かっていた。しかし、非平衡で開放的な蒸発界面から引き起こされる実際の分割現象は、核形成位置の平均的情報は得られるものの、その不確定さのため複数の核形成メカニズムについては未解明な特徴が多かった。
※1. https://www.jaist.ac.jp/whatsnew/press/2023/09/22-1.html

| 図. 界面分割現象における「対称性の破れ」: A. 空間軸の一つとしてセル幅を大きくしていくと、分割現象の特徴が現れる概念図。界面がゆらぎ、対称性が破れ、そして水中に分散していたポリマーが析出する核を非同期に形成する。B. 同一条件で得られる異なる分割(二分割、もしくは三分割)と、セル幅に対する核形成位置のデータ。C. 対称性の破れを加味した分岐モデル。核1と核2とは、タイミングがずれて発生する(時間的に同期していない)。 |
そこで今回、ポリマー分散液の一つの蒸発界面が、二つ、もしくは三つに分割される空間条件に焦点をあて、その核形成位置を詳細に検討した(図A)。確率統計論を通した界面科学的な解析から、それぞれの分割数に対して、「対称性の破れ」と「非同期性」が現れ、相互に関係し合う特徴であることが分かった。核の位置については平均化による統計評価ではなく、結果に対する場合分けを通し、特徴的な「ずれ」を評価した(図B)。すると、分割点の位置には偏りがあり、セル幅に対して均等に半分、もしくは均等に三分の一に分割するわけではない、という基本原理が明らかになった。実際、二分割される場合、核はセル幅の中心ではなく、中心からずれた位置に形成される傾向となった。この「ずれ」は、セル幅を少しずつ大きくすると顕著に現れ、三分割される場合、2番目の核形成が起こるタイミングや位置に大きく影響し、非同期性として現れた。この「対称性の破れ」と「非同期性」は、時間発展の現象理解に重要である(図C)。
また、この核間隔は、ポリマー水溶液の液相と空気の界面における毛管長が影響する。今回の実証実験では、粘性流体として多糖キトサン[用語解説6] の水分散系を用いており、5~8ミリメートル程度の間隔であった。これまでにいくつかの多糖でも分割現象は実証されており、研究グループは現在、様々な化学種・物質群への拡張や現象の特徴的メカニズムの解明を進めている。これらを通して、自然界にも通ずるパターン形成の普遍的理解が期待される。
本成果は、2025年6月4日に科学雑誌「Advanced Science」誌(WILEY社)のオンライン版で公開された。なお、本研究は、国立研究開発法人科学技術振興機構(JST) 創発的研究支援事業(JPMJFR201G)、日本学術振興会科研費 基盤研究B(JP23K21136)、日本学術振興会科研費 新学術領域研究(JP22H04532)、および公益財団法人旭硝子財団 若手継続グラントの支援のもと行われた。
【今後の展開】
生物を含め自然界には多様な散逸構造が在り、対称性の破れを明確に扱うことは重要である。パターン形成に関する歴史的研究にはチューリングパターン[用語解説7]などがあり、ソフトマテリアルを題材とした研究例も多い。これは、生物における自己組織化の理解や実空間におけるマテリアル設計に重要なテーマと認識されているためでもある。今回のような実検証を通じたパターン形成の理解が進めば、今後、高分子科学、コロイド科学、界面科学、材料科学、流体力学、非平衡科学、生命科学などの分野への進展に留まらない。実時空間と仮想時空間を通した数理科学、シミュレーション、データサイエンスなどとの融合によって、パターン形成の理解と材料設計に有用と期待される。
【論文情報】
| 掲載誌 | Advanced Science (WILEY) |
| 題目 | Symmetry breaking in meniscus splitting: Effects of boundary conditions and polymeric membrane growth |
| 著者 | Thi Kim Loc Nguyen, Taisuke Hatta, Koji Ogura, Yoshiya Tonomura, Kosuke Okeyoshi* |
| DOI | 10.1002/advs.202503807 |
| 掲載日 | 2025年6月4日 |
【用語解説】
令和7年6月4日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2025/06/04-1.html高分子ネットワークで人工光合成

高分子ネットワークで人工光合成
| 北陸先端科学技術大学院大学(学長・寺野稔、石川県能美市)サスティナブルイノベーション研究領域の萩原礼奈大学院生(博士後期課程)、桶葭興資准教授、東京大学(総長・藤井輝夫、東京都文京区)大学院工学系研究科の吉田亮教授の研究グループは、人工光合成ゲルの研究について特集論文を発表しました。 |
これまでの人工光合成[用語解説1]の研究では、有機/無機にかかわらず様々な物質群の探索と電子移動の向上に注力されてきました。しかし、その反応が起こる液相では、分子集団としての振る舞いが無秩序のため、拡散律速によるエネルギー損失が問題でした。一方、実際の光合成を行う葉緑体では、その内部に在るチラコイド膜によって区画されたナノ空間があります。この膜上では複数の分子団の位置関係が絶妙に制御されており、化学反応場として必要不可欠です。このような空間制御を可能とするシステムとしてゲル相は有用であり、ハイドロゲル[用語解説2]の網目構造は高いポテンシャルを持ちます(図)。事実、光エネルギー捕集分子、電子伝達分子、触媒分子など複数の機能団に高分子の網目構造を精密に導入することで、能動的な電子輸送が可能となります。例えば、光エネルギーによる水の分解には、同時に複数の電子が輸送される必要があり、多数の酸化還元反応が伴います。この化学反応が起こる場に、刺激応答性高分子[用語解説3]の網目を導入することで、反応に伴った高分子の伸び縮みを利用することができます。これによって電子の能動輸送が実現します。実際、光エネルギーによって水を分解して酸素発生や水素発生するゲルシステムが提案されました。
この人工光合成ゲルは、外界からのエネルギーや物質の授受が可能な開放系マテリアルで、生物に倣った物質システムです。今後も、高分子ネットワークを活用した機能性材料の設計は、様々なエネルギー変換システムの構築など、持続可能な社会の実現に資するものと考えられます。
本成果は、2024年11月1日(英国時間)に科学雑誌「Chemical Communications」誌(RSC社)のオンライン版で公開されました。また、本研究は、日本学術振興会科研費 挑戦的研究(萌芽)(JP21K18998)の支援のもと行われました。

| 図:葉緑体にヒントを得た人工光合成ゲルの概念図。A. 葉緑体の内部では、チラコイド膜に4つのタンパク質が連携して酸化還元反応を起こし、電子伝達が達成されている。B. 水の可視光分解に必要な4つの機能団を高分子ネットワークに組み込んだ概念図。 |
【論文情報】
| 掲載誌 | Chemical Communications (The Royal Society of Chemistry) |
| 論文題目 | Bioinspired hydrogels: polymeric designs towards artificial photosynthesis |
| 著者 | Reina Hagiwara, Ryo Yoshida, Kosuke Okeyoshi* |
| DOI | 10.1039/d4cc04033c |
| 掲載日 | 2024年11月1日付、オンライン版(オープンアクセス) |
【関連論文】
精密な高分子設計による能動的電子輸送が終始可能に
-高分子が触手のように電子を授受-(2023.12.14 プレスリリース)
https://www.jaist.ac.jp/whatsnew/press/2023/12/14-1.html
高分子の"伸び縮み"で「人工光合成」を加速する!
-電子伝達を制御する高分子の相転移(2019.6.12 Academist Journal)
https://academist-cf.com/journal/?p=11128
高分子の相転移を利用した人工光合成に成功
-可視光エネルギーによる高効率な水素生成を達成-(2019.5.15 プレスリリース)
https://www.jaist.ac.jp/whatsnew/press/2019/05/15-1.html
【用語解説】
令和6年11月6日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2024/11/06-1.html10月9日(水)~11日(金) BioJapan 2024に本学が出展
10月9日(水)~11日(金)の3日間、パシフィコ横浜(神奈川県横浜市)にて世界で最も歴史のあるバイオテクノロジー展である「BioJapan 2024」が開催されます。
本学からは松村 和明教授および山口 拓実准教授が参加し、ブース出展およびプレゼンテーションを行います。
ご来場の際には来場登録のうえ、ぜひお立ち寄りください。
(来場案内)https://jcd-expo.jp/ja/visitor.html
※事前登録:無料(当日の来場登録:5,000円)
| 日 時 | 10月9日(水)~10月11日(金) 各日 10時00分~17時00分 |
| 会 場 | パシフィコ横浜(神奈川県横浜市西区みなとみらい1-1-1) |
| ブース出展 | 【ブース名】国立大学法人北陸先端科学技術大学院大学 【小間番号】A-30 |
| 【ブース名】ARIM次世代バイオマテリアルハブ拠点 名古屋大学 【小間番号】B-21 ※本拠点のスポーク機関として本学が参画 |
|
| プレゼンテーション | 【日 時】10月11日(金)10時55分~11時25分 【場 所】Presentation Stage A 【テーマ】ARIM 次世代バイオマテリアル 『材料からバイオまで。大学の最先端設備で研究開発しませんか?』 【講演者】山口 拓実(JAIST)、大住 克史(名古屋大学) |
| 【日 時】10月11日(金)13時50分~14時20分 【場 所】Presentation Stage A 【テーマ】北陸先端科学技術大学院大学 超越バイオメディカルDX研究拠点 『超越バイオメディカルDX研究~細胞・タンパク質の保護マテリアル』 【講演者】松村 和明 |
詳細はこちらをご覧ください。
・BioJapan 2024 公式サイト
統合失調症の認知機能障害を回復する新薬候補 -脳移行性の皮下投与型ペプチドナノ製剤を開発-

   |
| 国立大学法人 国立大学法人広島大学 国立大学法人大阪大学 国立大学法人筑波大学 一丸ファルコス株式会社 |
統合失調症の認知機能障害を回復する新薬候補
-脳移行性の皮下投与型ペプチドナノ製剤を開発-
【ポイント】
- 統合失調症の発症に関係する神経ペプチド受容体VIPR2に対する選択的な阻害ペプチドKS-133と脳移行性のLRP1結合ペプチドKS-487を同時に搭載するナノ粒子を創製し、 皮下投与型のペプチド製剤として開発
- 本ペプチド製剤の皮下投与は、VIPR2の過剰な活性化によって引き起こされた動物モデルの認知機能の低下を正常レベルまで回復可能
- 本ペプチド製剤は、既存薬とは全く異なるメカニズムをもつため、統合失調症の新しい治療法の開発につながることが期待
| 北陸先端科学技術大学院大学(学長・寺野稔、石川県能美市)物質化学フロンティア研究領域の都英次郎准教授、広島大学(学長・越智光夫、広島県広島市)大学院医系科学研究科の吾郷由希夫教授、大阪大学(総長・西尾章治郎、大阪府吹田市)大学院薬学研究科の中川晋作教授、筑波大学(学長・永田恭介、茨城県つくば市)医学医療系の広川貴次教授、一丸ファルコス株式会社(社長・安藤芳彦、岐阜県本巣市)の坂元孝太郎開発2課長らの研究グループは、統合失調症の認知機能障害を回復する新薬になり得る脳移行性の皮下投与型ペプチドナノ製剤の開発に成功した(図1)。 |
 図1. 本研究の概念図
図1. 本研究の概念図
統合失調症は、幻覚や妄想などの陽性症状、意欲の低下などの陰性症状、そして注意・集中力の低下や記憶力・判断力の低下といった認知機能障害などを特徴とする精神疾患で、人口の約1%に発症し、その罹患者は日本では約80万人、全世界では2000万人以上いると言われている。既存薬は、神経伝達物質の調節に関わるメカニズムを有するもののみであり、その治療効果は限定的であり、特に認知機能障害に対する効果が乏しい。近年、神経ペプチド受容体VIPR2の過剰な活性化が統合失調症の発症に関与することが臨床研究および非臨床研究で明らかとなり、新たなメカニズムの統合失調症治療薬につながることが期待されている。本研究グループは、これまでにVIPR2を選択的に阻害するペプチドKS-133を見出していたものの(FrontPharmacol 2021,12:751587)、脳への移行性が低いことが課題であった。
本研究では、KS-133を脳に送り届けるためのナノ製剤化を検討した。血液脳関門に発現するLDL受容体関連タンパク質のLRP1は、物質を血中から脳組織に移行させる働きがある。本研究グループは、これまでにLRP1に結合するペプチドKS-487を見出していた(Biochem Biophys Rep 2022,32:101367)。そこで、1.LRP1とKS-487の複合体の構造解析を分子動力学シミュレーションで実施、2.その構造を元にKS-487を表面に提示するナノ粒子をデザイン、3.バイオイメージング試験で皮下投与されたKS-487提示ナノ粒子が脳に移行することを確認、4.KS-487提示ナノ粒子にKS-133を内包させたペプチド製剤を調製し、その効果を動物モデルで確認した。これらの結果、KS-133とKS-487を同時に搭載するナノ粒子が、KS-133を脳に効果的に移行させ、動物モデルの認知機能障害を健常レベルまで回復させることが分かった(図2)。

図2. 統合失調症モデルマウスでの認知機能を評価する試験。マウスは新しい環境や物体を積極的に探索する習性をもつ。マウスに二つの新しい物体AとBを探索させて、記憶させる。24時間後に既知物体であるBを新しい物体Cに置き換えて、マウスが物体Cをどれだけ探索するかを計測することで、マウスの物体認知、学習・記憶能力を解析する。物体AとCの総探索時間のうち、どれだけ物体Cを探索していたかを調べる識別指数を用いて評価する。数値が高いほど認知機能が高いことを意味する。統合失調症モデルマウスの識別指数は、VIPR2選択的阻害ペプチドKS-133を内包し、中枢移行性ペプチドKS-487を提示するナノ粒子の投与によって、正常マウスと同等レベルに回復する。
本研究成果は、アメリカ化学会発行の生物・化学系のトップジャーナル「JACS Au」(アメリカ化学会発行)のオンライン版に2024年6月20日に掲載された。なお、本研究は、文部科学省科研費 基盤研究(A)(23H00551)、基盤研究(B)(20H03392)、挑戦的研究(開拓)(22K18440)、国立研究開発法人科学技術振興機構(JST)研究成果最適展開支援プログラム(A-STEP)(JPMJTR22U1)、AMED橋渡し研究プログラム(JP22ym0126809)、創薬等先端技術支援基盤プラットフォーム(BINDS)(JP18am0101114、JP23ama121052、JP23ama121054)、公益財団法人発酵研究所、公益財団法人上原記念生命科学財団、ならびに北陸先端科学技術大学院大学超越バイオメディカルDX研究拠点、生体機能・感覚研究センター、広島大学トランスレーショナルリサーチセンターの支援などのもと行われたものである。
【今後の展開】
本ペプチド製剤は、VIPR2阻害という既存薬とは全く異なるメカニズムを有しており、アンメットメディカルニーズである統合失調症の認知機能障害を対象とした新薬になることが期待される。今後、細胞や動物モデルなどを用いた更なる検討、そしてヒトでの臨床試験によって、本ペプチド製剤の有効性と安全性を確認し、統合失調症の新しい治療薬として開発を進めていく。
【論文情報】
| 掲載誌 | JACS Au (アメリカ化学会誌) |
| 論文題目 | Cyclic Peptide KS-133 and KS-487 Multifunctionalized Nanoparticles Enable Efficient Brain Targeting for Treating Schizophrenia |
| 著者 | Kotaro Sakamoto*, Seigo Iwata, Zihao Jin, Lu Chen, Tatsunori Miyaoka, Mei Yamada, Kaiga Katahira, Rei Yokoyama, Ami Ono, Satoshi Asano, Kotaro Tanimoto, Rika Ishimura, Shinsaku Nakagawa, Takatsugu Hirokawa, Yukio Ago*, and Eijiro Miyako* |
| 掲載日 | 2024年6月20日 |
| DOI | https://doi.org/10.1021/jacsau.4c00311 |
令和6年6月27日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2024/06/27-1.html金沢大学・北陸先端科学技術大学院大学 第2回共同シンポジウムを開催
令和5年12月12日(火)、金沢大学宝町キャンパス 医学図書館2階 十全記念スタジオにおいて、金沢大学・北陸先端科学技術大学院大学 第2回共同シンポジウムが開催されました。
金沢大学と本学は、融合科学共同専攻における分野融合型研究を推進してきましたが、今年度より、融合科学共同専攻にとどまらず、両大学間の共同研究の発展と促進を目指し、共同シンポジウムを開催しています。第1回目は令和5年6月26日に本学にて開催いたしましたが、第2回目である今回は「バイオメディカル」をテーマに、金沢大学にて開催いたしました。
金沢大学 和田隆志学長による開会挨拶後、本学 超越バイオメディカルDX研究拠点長 松村和明教授、金沢大学 附属病院眼科 小林 顕講師、金沢大学 医薬保健研究域医学系 三枝理博教授、本学 バイオ機能医工学研究領域 筒井秀和准教授がそれぞれバイオメディカル関連の最新研究について講演し、本学 寺野稔学長の挨拶をもって閉会となりました。
両学長は、開会・閉会の挨拶の際に、本シンポジウムをきっかけとしたシーズ開発や社会実装、および研究連携を中枢とした両大学の発展への期待について述べられました。また、本シンポジウムが、今後の両大学間の共同研究の発展と促進を目的としていることから、各講師の先生方は、自身の研究内容の説明に加えて、「どのような研究分野との共同研究が可能か」という点も併せて講演されました。
オンライン配信とのハイフレックス形式にて開催しました本シンポジウムには、両大学より多くの方が参加され、質疑応答の時間には講演内容に関する活発な意見交換が研究者間で行われました。次回は本学を会場として開催される予定です。本シンポジウムが今後両大学間の共同研究発展の端緒となるよう推進して参ります。

開会の挨拶をする金沢大学 和田学長

講演①「両性電解質高分子による細胞凍結保護とタンパク質安定化作用」
松村 和明 教授(本学 超越バイオメディカルDX研究拠点長)

講演②「水疱性角膜症治療 (角膜内皮移植)の進歩」
小林 顕 講師(金沢大学附属病院 眼科)

講演③「中枢体内時計神経ネットワークの動作原理解明と操作に向けて」
三枝 理博 教授(金沢大学医薬保健研究域医学系)

講演④「細胞認識能を備えた電気生理学計測法の構築にむけて」
筒井 秀和 准教授(本学 バイオ機能医工学研究領域)

閉会の挨拶をする寺野学長
令和5年12月15日
出典:JAIST お知らせ https://www.jaist.ac.jp/whatsnew/info/2023/12/15-1.html第2回 金沢大学・北陸先端科学技術大学院大学 共同シンポジウム
| 開催日時 | 令和5年12月12日(火)13:30~16:15 |
| 会 場 | 金沢大学宝町キャンパス(金沢市宝町13-1) 医学図書館2階 十全記念スタジオ ※Webexにて同時配信(対面・オンラインのハイフレックス) |
| 対 象 | 両大学の教職員・学生 |
| テーマ | バイオメディカル |
| プログラム | 13:30~ オープニング(共同シンポジウムの趣旨説明等) 13:35~ 開会挨拶 金沢大学 和田 隆志 学長 13:40~14:15 ≪講演1≫ *講演:30分、質疑応答:5分 講演者:松村 和明 教授 本学 超越バイオメディカルDX研究拠点長、 物質化学フロンティア研究領域長 講演タイトル:両性電解質高分子による細胞凍結保護とタンパク質安定化作用 14:15~14:50 ≪講演2≫ *講演:30分、質疑応答:5分 講演者:小林 顕 講師 金沢大学附属病院 眼科 講演タイトル:水疱性角膜症治療(角膜内皮移植)の進歩 14:50~15:00 休憩 15:00~15:35 ≪講演3≫ *講演:30分、質疑応答:5分 講演者:三枝 理博 教授 金沢大学 医薬保健研究域医学系 講演タイトル:中枢体内時計神経ネットワークの動作原理解明と操作に向けて 15:35~16:10 ≪講演4≫ *講演:30分、質疑応答:5分 講演者:筒井 秀和 准教授 本学 バイオ機能医工学研究領域 講演タイトル:細胞認識能を備えた電気生理学計測法の構築にむけて 16:10~16:15 閉会挨拶 北陸先端科学技術大学院大学 寺野 稔 学長 |
| 参加申込 | 下記申込み用フォームからお申込みください パソコン用フォームURL https://ws.formzu.net/fgen/S82865089/ スマホ用フォームURL https://ws.formzu.net/sfgen/S82865089/ |
| 備 考 | 〇会場での参加、オンライン参加ともに事前申込みが必要です。 〇会場には来客用駐車スペースがありませんので、対面参加をご希望の方は、公共交通機関ご利用にご協力ください。 〇オンライン参加の方には、アクセス用URLをご連絡いただいたメールアドレスに後日送信いたします。 |
| 問合せ先 | 研究推進課 学術研究推進係 内線:1907/1912 E-mail:suishin@ml.jaist.ac.jp |
多機能ナノ粒子を用いて、無傷のリソソームを迅速かつ高純度に単離する手法を開発

  |
国立大学法人北陸先端科学技術大学院大学 国立大学法人東北大学 |
多機能ナノ粒子を用いて、無傷のリソソームを迅速かつ高純度に単離する手法を開発
ポイント
- 磁性―プラズモンハイブリッドナノ粒子を哺乳動物細胞のリソソーム内腔へエンドサイトーシス*1経路で高効率に送達することに成功
- ハイブリッドナノ粒子の細胞内輸送過程をプラズモンイメージング*2によって精確に追跡することで、高純度にリソソームを磁気分離するための最適培養時間を容易に決定可能
- リソソーム内腔にハイブリッドナノ粒子を送達後、細胞膜を温和に破砕し、4℃で30分以内にリソソームを磁気分離することで、細胞内の状態を維持したままリソソームの高純度単離に成功
| 北陸先端科学技術大学院大学(JAIST)(学長:寺野 稔、石川県能美市) 先端科学技術研究科 前之園 信也 教授、松村 和明 教授、平塚 祐一 准教授の研究チームは、東北大学(総長:大野 英男、宮城県仙台市)大学院生命科学研究科の田口 友彦教授と共同で、磁気分離能(超常磁性)とバイオイメージング能(プラズモン散乱*3特性)を兼ね備えた多機能ナノ粒子(磁性―プラズモンハイブリッドナノ粒子)を用いて、細胞内の状態を維持したままリソソームを迅速かつ高純度に単離する技術を世界で初めて開発しました。 |
【背景と経緯】
リソソームは60を超える加水分解酵素とさまざまな膜タンパク質を含む細胞小器官(オルガネラ)で、タンパク質、炭水化物、脂質、ヌクレオチドなどの高分子の分解と再利用に主要な役割を果たします。これらの機能に加えて、最近の発見では、リソソームがアミノ酸シグナル伝達にも関与していることがわかってきています。リソソーム機能障害に由来する疾患も数多く存在します。そのため、リソソームの機能をより深く理解することは基礎生物学においても医学においても重要な課題です。
リソソームの代謝物の探索は、近年急速に関心が高まっている研究分野です。たとえば、飢餓状態と栄養が豊富な状態でリソソームの代謝物を研究することにより、アミノ酸の流出がV-ATPaseおよびmTORに依存することが示されました(M. Abu-Remaileh et al., Science, 2017, 358, 807)。このように、外部刺激に応答したリソソームの動的な性質を調べるためには、リソソームを細胞内の状態を維持したまま迅速かつ高純度に分離する必要があります。
一般的に、リソソームの単離は密度勾配超遠心分離法*4によって行われていますが、密度勾配超遠心分離法には二つの大きな問題があります。まず一つ目の問題として、細胞破砕液にはほぼ同じ大きさと密度を持ったオルガネラが多種類あるため、得られた画分にはリソソーム以外の別のオルガネラが不純物として混ざっていることがよくあります。したがって、リソソーム画分のプロテオミクス解析を行っても、完全な状態のリソソームに関する情報を得ることができません。二つ目の問題として、分離プロセスに長い時間がかかるため、リソソームに存在する不安定なタンパク質は脱離、変性、または分解される可能性があります。この問題も、リソソームに関する情報を得ることを大きく妨げます。
これらの問題を克服するために、リソソームを迅速に単離するための他の技術が開発されました。たとえば、磁気ビーズを用いた免疫沈降法*5によってリソソームを迅速に分離できることが示されました(M. Abu-Remaileh et al., Science, 2017, 358, 807)。しかし、この手法では、ウイルスベクターのトランスフェクションなどによって抗体修飾磁気ビーズが結合できるリソソーム膜貫通タンパク質を発現させる必要があります。この方法は、密度勾配超遠心分離法よりも高純度のリソソーム画分が得られますが、リソソーム膜のタンパク質組成とその後のプロテオミクス解析に悪影響を与える可能性が指摘されています(J. Singh et al., J. Proteome Res., 2020, 19, 371-381.)。
【研究の内容】
本研究では、無傷のリソソームを迅速かつ効率的に分離する新たな単離法として、アミノデキストラン(aDxt)で表面修飾したAg/FeCo/Ag コア/シェル/シェル型磁性―プラズモンハイブリッドナノ粒子(MPNPs)をエンドサイトーシス経路を介してリソソームの内腔に集積した後、細胞膜を温和に破砕し、リソソームを磁気分離するという手法を開発しました(図1)。リソソームの高純度単離のためには、エンドサイトーシス経路におけるaDxt結合MPNPs(aDxt-MPNPs)の細胞内輸送を精確に追跡することが必要となります。そこで、aDxt-MPNPsとオルガネラの共局在の時間変化を、aDxt-MPNPsのプラズモンイメージングとオルガネラ(初期エンドソーム、後期エンドソームおよびリソソーム)の免疫染色によって追跡しました(図2)。初期エンドソームおよび後期エンドソームからのaDxt-MPNPsの脱離と、リソソーム内腔へのaDxt-MPNPsの十分な蓄積に必要な最適培養時間を決定し、その時間だけ培養後、リソソームを迅速かつマイルドに磁気分離しました。細胞破砕からリソソーム単離完了までの経過時間(tdelay)と温度(T)を変化させることにより、リソソームのタンパク質組成に対するtdelayとTの影響をアミノ酸分析によって調べました。その結果、リソソームの構造は細胞破砕後すぐに損なわれることがわかり、リソソームを可能な限り無傷で高純度で分離するには、tdelay ≤ 30分およびT = 4℃という条件で磁気分離する必要があることがわかりました(図3)。これらの条件を満たすことは密度勾配超遠心分離法では原理的に困難であり、エンドサイトーシスという細胞の営みを利用して人為的にリソソームを帯磁させて迅速かつ温和に単離する本手法の優位性が明らかとなりました。
本研究成果は、2022年1月3日(米国東部標準時間)に米国化学会の学術誌「ACS Nano」のオンライン版に掲載されました。
【今後の展開】
本手法はリソソーム以外のオルガネラの単離にも応用可能な汎用性のある技術であり、オルガネラの新たな高純度単離技術としての展開が期待されます。

図1 磁性―プラズモンハイブリッドナノ粒子を用いたリソソームの迅速・高純度単離法の概念図

| 図2 COS-1細胞におけるaDxt-MPNPsの細胞内輸送。 (A)aDxt-MPNPsの細胞内輸送の概略図(tは培養時間)。 (B)aDxt-MPNPsとリソソームマーカータンパク質(LAMP1)の共局在を示す共焦点レーザー走査顕微鏡像 (核:青、aDxt-MPNPs:緑、リソソーム:赤)。 aDxt-MPNPsはプラズモンイメージングによって可視化。 スケールバーは20 µm。 |

| 図3 単離されたリソソームのウエスタンブロッティングおよびアミノ酸組成分析の結果。 (A)ネガティブセレクション(NS)およびポジティブセレクション(PS)画分。 (B)PS画分の共焦点レーザー走査顕微鏡画像(緑:aDxt-MPNPs、赤:LAMP1)。 (C)NSおよびPS画分、および細胞破砕液のウエスタンブロット結果。 (D)異なる温度でtdelayを変化した際に得られたリソソーム画分のアミノ酸含有量の変化。 水色(4℃、tdelay = 30分)、青(4℃、tdelay = 120分)、ピンク(25℃、tdelay = 30分)、 および赤(25℃、tdelay = 120分)。 |
【論文情報】
| 掲載誌 | ACS Nano |
| 論文題目 | Quick and Mild Isolation of Intact Lysosomes Using Magnetic-Plasmonic Hybrid Nanoparticles (磁性―プラズモンハイブリッドナノ粒子を用いた完全な状態のリソソームの迅速かつ温和な単離) |
| 著者 | The Son Le, Mari Takahashi, Noriyoshi Isozumi, Akio Miyazato, Yuichi Hiratsuka, Kazuaki Matsumura, Tomohiko Taguchi, Shinya Maenosono* |
| 掲載日 | 2022年1月3日(米国東部標準時間)にオンライン版に掲載 |
| DOI | 10.1021/acsnano.1c08474 |
【用語説明】
*1.エンドサイトーシス:
細胞が細胞外の物質を取り込む過程の一つ
*2.プラズモンイメージング:
プラズモン散乱を用いて、光の回折限界以下のサイズの金属ナノ粒子を光学顕微鏡(蛍光顕微鏡や共焦点顕微鏡など)で可視化すること
*3.プラズモン散乱:
金属ナノ粒子表面での自由電子の集合振動である局在表面プラズモンと可視光との相互作用により、可視光が強く散乱される現象
*4.密度勾配超遠心分離法:
密度勾配のある媒体中でサンプルに遠心力を与えることで、サンプル中の構成成分がその密度に応じて分離される方法
*5.免疫沈降法:
特定の抗原を認識する抗体を表面修飾したビーズ用い、標的抗原が発現したオルガネラを細胞破砕液中から選択的に分離する免疫化学的手法
令和4年1月5日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2022/01/05-2.html生体分子モーターで動く人工筋肉、光で自在に作製可能 ― マイクロ・ソフトロボットの3Dプリントの実現に期待 ―

 |
| 国立大学法人 北陸先端科学技術大学院大学 国立大学法人東海国立大学機構 岐阜大学 国立大学法人 大阪大学 |
生体分子モーターで動く人工筋肉、光で自在に作製可能
― マイクロ・ソフトロボットの3Dプリントの実現に期待 ―
ポイント
- 光照射した場所に自在な形状に作製できる人工筋肉の開発に成功
- 遺伝子工学的に改変した生体分子モーターからなる光応答性の分子システムを開発
- ミリメートルスケールの微小機械の駆動を実証
- マイクロロボットやソフトロボットの3Dプリントの実現に期待
| 北陸先端科学技術大学院大学・先端科学技術研究科 生命機能工学領域の平塚祐一准教授、杜釗 大学院生(博士前期課程)は、岐阜大学・工学部の新田高洋准教授、大阪大学・大学院工学研究科 機械工学専攻の森島圭祐教授、王穎哲 大学院生(博士後期課程/特任研究員)との共同研究で、筋肉のような収縮性のファイバー(以下、人工筋肉)を、光照射した場所に自在に形成させることに成功した。この人工筋肉は、生物の動きに関わるタンパク質である生体分子モーターを遺伝子工学的に改変することにより実現した。光の照射形状を変えることで自由な形状・大きさの人工筋肉が造形でき、ミリメートルスケールの微小機械の動力に利用できることを実証した。この成果は将来、これまで困難であったマイクロロボットやソフトロボットの3Dプリンタによる製造への応用が期待される。 本研究成果は、2021年4月19日(英国時間)に科学雑誌「Nature Materials」誌のオンライン版で公開された。なお、本研究は新エネルギー・産業技術総合開発機構(NEDO)「次世代人工知能・ロボット中核技術開発」(JPNP15009)、日本学術振興会(JSPS)科研費 新学術領域研究「分子ロボティクス」の支援を受けて行われた。 |
【研究背景と内容】
生物のエンジン「筋肉」は、モータータンパク質[*1]と呼ばれる生体分子モーターから構築されており、数百マイクロメートル(マイクロは100万分の1)から数十メートルまでスケーラビリティにとんだアクチュエータである。生物のエネルギー源(アデノシン三リン酸 (ATP))を用いて高い効率で力学的仕事を行うという、従来のアクチュエータと比べ質的に異なる特性を持ち、これまでには無い産業分野での応用が期待されている。しかし、筋肉自体または筋肉細胞をアクチュエータとして利用する試みは基礎研究レベルでは報告されているが、筋肉細胞の安定性・保存性の問題やアクチュエータとして組み込む技術が未発達のため、実用化には至っていない。また、筋肉組織の構成分子はほぼ同定されているが、それら構成分子から筋肉を再構築する技術は知られていなかった。
本研究では、生体内の収縮性ファイバーの形成過程に着想を得て、人工筋肉を自在に形成させる分子システムを開発した。モータータンパク質の一種であるキネシンを遺伝子工学的に改変し、フィラメント状にすることにより、レールタンパク質である微小管[*2]と混ぜるだけで、モータータンパク質の動的な機能により自己組織的に人工筋肉を形成させることができた。さらに、光照射によりモーター分子のフィラメント化を開始させ、照射した部位のみに人工筋肉を形成させることを可能とした(図1)。この人工筋肉を大きさ数ミリメートルの機械構造内に形成させることにより微小機械を駆動させることに成功した(図2)。
筋肉のような柔軟で低エネルギー・低環境負荷なアクチュエータの産業応用は期待されているが、上述のように実用化には至っていない。本研究では、生体の運動素子であるモータータンパク質分子を数ミリメートル以上の組織に構築することにより、生物の筋肉に似た機能・性質を持つ人工筋肉の製造を可能とした。特に光照射により人工筋肉の形成を開始可能なことから、たとえば光造形型の3Dプリンタに組み込めば人工筋肉の光造形などが可能になることが将来期待でき、生体材料で駆動するマイクロロボットやソフトロボットの3Dプリント技術の基盤技術となる可能性が高い。
【今後の展開】
本研究で開発された人工筋肉は、現時点では形成・収縮が同時に起こり、かつ収縮は一回のみで用途も限定される。今後、制御用の分子システムを開発することにより、可逆または振動可能な人工筋肉を開発しマイクロロボットやソフトロボットへの実装を目指す。

図1.光照射による人工筋肉形成のコンセプト図
モータータンパク質の一種キネシンを遺伝子工学的に改変し、光照射によりキネシンがフィラメント状になるように設計(K456m13とCaMLMM)。キネシンフィラメントは自身の運動能により微小管を引っ張り、自己組織的に筋肉に似た収縮性の繊維を形成する。

図2. 人工筋肉の応用例
大きさ数ミリメートルのシリコンゴム製の微小構造の周囲に、光照射により人工筋肉を形成させ、その構造を駆動させた。右上)マイクログリッパ:光照射後に人工筋肉(オレンジ色)が形成し、20秒後にグリッパが閉じる。右下)昆虫型デバイス:人工筋肉により左右に動く。左上)ロボットアーム型デバイス。左中)微小歯車の組み立て。左下)細胞サイズの微小ビーズの集積。
【研究資金】
・新エネルギー・産業技術総合開発機構(NEDO)「次世代人工知能・ロボット中核技術開発」(JPNP15009)
・日本学術振興会(JSPS)科研費 新学術領域研究「分子ロボティクス」(JP24104004)
・日本学術振興会(JSPS)科研費 基盤研究(B)(JP18H01407)
【論文情報】
| 雑誌名 | Nature Materials |
| 題名 | "A printable active network actuator built from an engineered biomolecular motor" |
| 著者名 | Takahiro Nitta, Yingzhe Wang, Zhao Du, Keisuke Morishima and Yuichi Hiratsuka* |
| 掲載日 | 2021年4月19日(英国時間)にオンライン版に掲載 |
| DOI | 10.1038/s41563-021-00969-6 |
【用語解説】
[*1] モータータンパク質(motor protein)
生体の動きに関与するタンパク質の総称。大きさ数ナノメートル〜数十ナノメートルの分子で、代表的なものとして筋収縮に働くミオシン、細胞内の物質輸送に働くキネシン、鞭毛運動等に働くダイニンなどが挙げられる。これらは繊維状のタンパク質であるアクチンまたは微小管の上を生体のエネルギーであるATP(アデノシン三リン酸)の加水分解エネルギーを利用して一方向に動く。
[*2] 微小管(microtubule)
細胞骨格を構成する繊維状タンパク質のひとつ。大きさ数ナノメートルのチューブリンが筒状に重合することにより直径25ナノメートルの管状の繊維を形成する。キネシンやダイニンなどモータータンパク質が動くレールとして働く。
令和3年4月20日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2021/04/20-1.html科学技術振興機構(JST)「研究成果最適展開支援プログラム(A-STEP)」に3件が採択
科学技術振興機構(JST)の「研究成果最適展開支援プログラム(A-STEP)産学共同(育成型)」及び「研究成果最適展開支援プログラム(A-STEP)トライアウト」に本学から以下の3件の研究課題が採択されました。
A-STEPは、大学・公的研究機関等で生まれた科学技術に関する研究成果を国民経済上重要な技術として実用化することで、研究成果の社会還元を目指す技術移転支援プログラムで、大学等が創出する社会実装志向の多様な技術シーズの掘り起こしや、先端的基礎研究成果を持つ研究者の企業探索段階からの支援を、適切なハンズオン支援の下で研究開発を推進することで、中核技術の構築や実用化開発等の推進を通じた企業への技術移転を行います。
また、大学等の研究成果の技術移転に伴う技術リスクを顕在化し、それを解消することで企業による製品化に向けた開発が可能となる段階まで支援することを目的とし、研究開発の状況に応じて、リスクの解消に適した複数のメニューを設けています。
*詳しくは、JSTホームページをご覧ください。
「研究成果最適展開支援プログラム(A-STEP)産学共同(育成型)」
- 研究課題名:高感度FETと等温増幅法によるウイルス・病原菌センサー開発
- 研究課題名:分離回収可能なタンパク質凝集抑制ナノ構造体
- 研究概要:機能性タンパク質の凝集抑制高分子ナノ構造体を創生し、バイオ医薬品の製造効率の向上を目指すとともに、長期保存、安定化剤としての応用展開を目指す。バイオ医薬品は、製造工程において凝集などによる効率低下や長期保存性が問題となっている。我々は双性イオン高分子がタンパク凝集抑制などの安定化作用を示すことを報告してきている。本申請ではこの化合物の分子設計の最適化を行い、磁性ナノ粒子やナノゲルの様なナノ構造体とする事で、分離回収可能な保護デバイスを創出する。この高分子は、凝集してしまったタンパク質をリフォールディングする事も可能であり、応用面のみならず学術面からの重要性も高い。
- 採択にあたって一言:世界の医薬品の主流が低分子医薬品からバイオ医薬品へシフトしている中で、抗体医薬などの安定性の問題を解決するための凝集抑制高分子の開発を行っています。今回採択された研究課題では、添加した状態でタンパク質医薬品を安定化させ、必要な時には完全に分離回収できる安全かつ高性能な凝集抑制構造体を開発します。この成果により、これまで不安定で産業化できなかった効果の高いバイオ医薬品の開発やその長期保存技術に貢献したいと考えています。
「研究成果最適展開支援プログラム(A-STEP)トライアウト」
- 研究課題名:襲雷予測システムのためのグラフェン超高感度電界センサの開発
- 研究概要:雷の事故による世界の死者は年間2万4千人にのぼり、我が国の電気設備における雷被害額は年間2千億円にのぼっている。雷雲の接近により、地表では電界が発生し、変化する。従って、正と負の電界センシングが雷の予測に極めて重要である。既存の超小型電界センサは、極性判定ができないため、これまで、雷に伴う事故について、落雷後の分析はあるが、落雷前の検知は出来ていなかった。グラフェン電界センサは負の電界を検出することができ、超高感度化と正・負が実現できれば、襲雷を予測することができる。
- 採択にあたって一言:襲雷を予測するためには、ピンポイント性、リアルタイム性が要求されます。今回、グラフェン電界センサの超高感度化の研究を進め、音羽電機工業株式会社と共同で、学校、消防、自治体などに襲雷予測システムを設置し、地域社会の持続的な発展に貢献していきたいと思います。
令和2年11月20日
出典:JAIST お知らせ https://www.jaist.ac.jp/whatsnew/info/2020/11/20-1.html世界初 キヌアからブラッダー細胞形成遺伝子を発見


世界初 キヌアからブラッダー細胞形成遺伝子を発見
石川県立大学 森 正之准教授、今村 智弘特任講師、古賀 博則客員教授、高木 宏樹准教授、北陸先端科学技術大学院大学先端科学技術研究科、生命機能工学領域の大木 進野教授らは、(公財)岩手生物工学研究センターなどの機関と共同で、塩生植物キヌア(Chenopodium quinoa)からブラッター細胞の形成に関わる遺伝子を発見しました。 本研究成果は、「Communications Biology」で公開されました。
<ポイント>
- キヌアからブラッダー細胞形成に関わる新規WD40タンパク質をコードするREBC遺伝子を発見
- REBC遺伝子は、ブラッダー細胞形成のみならず葉緑体形成にも関与していることを発見
- ブラッダー細胞の茎頂保護機能を発見
<発表論文>
| 論文タイトル | A novel WD40-repeat protein involved in formation of epidermal bladder cells in the halophyte quinoa |
| 論文著者 | Tomohiro Imamura, Yasuo Yasui, Hironori Koga, Hiroki Takagi, Akira Abe, Kanako Nishizawa, Nobuyuki Mizuno, Shinya Ohki, Hiroharu Mizukoshi, and Masashi Mori |
| 雑誌 | Communications Biology (DOI: 10.1038/s42003-020-01249-w) |
<研究の背景>
国連大学の報告によると、世界の灌漑地の約1/5が塩害にさらされています。その被害は、年間およそ273億USドルの経済損失を引き起していることが報告されており、今後さらに広がることが予想されています。一方、世界の人口は、2050年までに97億人に達することが予想されております。そのため、この人口の爆発的な増加に耐えうる食糧生産は、早急に解決すべき大きな課題となっております。しかし、主要穀物である小麦やイネなどは、塩に弱いで植物であり、これらの主要穀物に対する塩害は、食糧生産において大きな問題となります。キヌアは、非常に高い耐乾燥性と耐塩性を併せ持ち、他の植物では生育困難な厳しい環境で生育できる塩生擬似穀物です。さらに、キヌアの種子は、必須アミノ酸・ミネラル・植物繊維を豊富に含み高い栄養価を持つことから、国際連合食糧農業機関(FAO)では、世界の食糧問題解決の切り札になり得るスーパーフードとして注目されています。
キヌアを含めたアカザ属植物は、植物体の表面に球状の表皮細胞(ブラッダー細胞)を形成します(図1)。ブラッダー細胞は、通常細胞の1000倍以上の大きさがあり、細胞内に高濃度の塩を蓄積することが知られています。このブラッダー細胞の性質は、キヌアの高い塩耐性の一因と考えられています。独自の形態と機能を持つブラッダー細胞ですが、その形成メカニズムは全く分かっていませんでした。
本研究では、塩生植物のキヌアに形成されるブラッダー細胞の形成機構を明らかにするために、ブラッダー細胞の形成に関わる遺伝子の単離を試みました。その結果、EMS処理の変異原処理により、ブラッダー細胞が著しく減少したrebc変異体を獲得し、次世代シークエンサーを用いた解析により、ブラッダー細胞形成に関わるrebc変異体の原因遺伝子(REBC)の単離に成功しました。その単離したREBC遺伝子は、ブラッダー細胞を形成しない植物には存在しないことが明らかとなりました。このことから、ブラッダー細胞の形成機構は、同じ植物の表皮細胞であるトライコームの形成機構とは異なることが示唆されました。さらに、rebc変異体はブラッダー細胞の形成のみならず葉緑体の形成にも影響を及ぼしていることが明らかとなりました。また、rebc変異体を用いた環境ストレス実験により、ブラッダー細胞は、塩を蓄積するだけでなく、その細胞を密集させることにより茎頂などの組織を環境ストレスから保護していることが明らかとなりました。
<研究の内容>
1.ブラッダー細胞が減少した変異体の作出
ブラッター細胞の形成に関わる遺伝子を単離するために、約8000粒のキヌア種子ついて、EMSを用いた変異原処理を実施しました。その結果、大部分のブラッダー細胞が欠失した変異体を得ることができました(図2)。この変異体を reduced epidermal bladder cells (REBC)変異体と命名しました。rebc変異体の分離比を確認しましたところ、野生型とrebc変異の割合が3:1に分離しました。興味深いことに、キヌアは異質4倍体の植物にもかかわらず、rebcの形質は、一遺伝子支配の劣勢形質であることがわかりました。
2.環境ストレス試験
キヌアは、ブラッダー細胞に塩を高濃度に蓄積することにより、高塩環境においても正常に生育できることが知られています。そこで、大部分のブラッダーが欠失したrebc変異体について、塩ストレス実験を実施しました。その結果、rebc変異体は、野生型に比べて高濃度の塩条件において生育が阻害されていることがわかりました。さらに、別の環境ストレスとして、茎頂に風を当て続けたところ、野生型では問題なく生育したのですが、rebc変異体では風によって茎頂にダメージを受けていることが明らかとなりました(図3)。これらの実験からブラッダー細胞は、塩を蓄積する機能のほかに、茎頂などの特定の組織に密集して存在することにより、風などの環境ストレスから組織を保護していることが新たに明らかとなりました。
3.rebc変異体の原因遺伝子の特定
rebc変異体の原因遺伝子を明らかにするために、次世代シークエンサーを用いたin silico subtraction 法を利用して変異箇所の特定を試みました。その結果、rebc変異体は、新規なWD40ドメインタンパク質遺伝子の変異が原因であることを明らかにし、その遺伝子をREDUCED EPIDERMAL BLADDER CELLS (REBC)遺伝子と名付けました(図4)。他植物の表皮細胞であるトライコームでは、その形成に関与する遺伝子が同定されており、その中でWD40ドメインタンパク質としてTTG1遺伝子が重要な役割をしています。REBCとTTG1を比較したところ、これらのタンパク質は、別の機能を持つタンパク質であることが示唆されました(図5)。またトライコームを形成する植物体には、REBC遺伝子のオルソログが存在しませんでした。これらの結果より、ブラッダー細胞の形成は、トライコームとは異なる機構の存在が示唆されました。
4.rebc変異体における葉緑体形成
rebc変異体について、網羅的な発現解析を実施したところ、発現が変動した遺伝子の多くが葉緑体局在タンパク質をコードする遺伝子でありました。さらに、クロロフィル含量を測定したところ、rebc変異体のクロロフィル含量が有意に低下していることが明らかとなりました。そこで、rebc変異体の葉緑体の形態について、電子顕微鏡を用いて観察しました。その結果、rebc変異体の葉緑体は、内部構造の約1/3が欠失していることが明らかとなりました(図6)。さらに、ブラッダー細胞の葉緑体を観察した結果、rebc変異体のブラッダー細胞の中の葉緑体は、野生型に比べクロロフィルの自家蛍光の強度が低下し、さらにブラッダー細胞あたりの葉緑体数が減少していることが明らかとなりました。以上の結果より、rebc変異体は、ブラッダー細胞の形成のみならず、葉緑体の形成にも影響を及ぼしていることが明らかになりました。
<今後の展望>
本研究成果によって、キヌアのブラッダー細胞形成に関する分子メカニズムの一端を明らかにすることができました。今後、ブラッダー細胞の形成に関する分子メカニズムの全容が明らかになることが期待できます。さらに、ブラッダー細胞形成の知見を利用することによって、キヌアの塩耐性機構を組み入れた新たなコンセプトの環境ストレス耐性作物を作出することが期待できます。

図1 キヌアのブラッダー細胞 (a)キヌア植物体、(b)キヌアの葉(裏側)、(c)キヌアの葉(拡大)、
(d-f) キヌアブラッダー細胞 BC:ブラッダー細胞、SC: 柄細胞

図2 rebc変異体について (a-c)キヌア芽生え (d-f)キヌア芽生え(茎頂付近)
(a, d)野生型、(b, e)rebc1変異体、(c, f)rebc2変異体

図3 風ストレス処理による影響 (a)野生型、(b)rebc1変異体、(c)rebc2変異体
・rebc変異体は風ストレスによって、茎頂が枯死している。

図4 REBC遺伝子の単離 (a) REBC遺伝子の概略図 赤矢印はrebc変異体の変異箇所
(b)rebc1×rebc2交配後代(F1)の解析
・rebc1×rebc2交配個体も、rebc変異の形質を示したことから、REBCが原因遺伝子であることが明らかとなった。

図5 (a) REBCとTTG1との比較(系統樹解析)、(b) アラビドプシスttg1変異体を用いた相補実験
上段:ベクターコントロール、中段:REBC過剰発現体、下段:AtTTG1過剰発現体
・REBCタンパク質は、TTG1タンパク質とは別のグループに属し、TTG1の機能を相補することができない。

図6 rebc変異体の葉緑体について (a-c) 走査型電子顕微鏡像 (b-f)透過型電子顕微鏡像
(a, d)野生型、(b, e)rebc1変異体、(c, f)rebc2変異体
・rebc変異体では、葉緑体の膜構造1/3が欠失している。
<用語説明>
- キヌア
ヒユ科アカザ亜科アカザ属の植物。南米アンデス原産の穀物で必須アミノ酸・ミネラル・植物繊維を豊富に含み高い栄養価を持ち、さらに、環境適応能力が高く、非常に高い耐乾燥性と耐塩性を合わせ持ち、国際連合食糧農業機関(FAO)は、世界の食糧問題解決の切り札になり得る作物として注目している。近年、我々のグループとその他のグループによってキヌアゲノムが解読され、キヌアが持つ環境ストレス耐性および高栄養価についての遺伝子研究が進められている。 - 擬似穀物
米や麦などのイネ科(禾穀類)や、大豆や小豆などのマメ科(菽穀類)ではないが、見た目がイネ科の穀物に類似した食べられる種子を形成する植物(ソバ、キヌア、アマランサスなど)を指す。 - in silico subtraction法
次世代シークエンサーのシークエンスデータを用いて、サンプル間の塩基配列の違い(多型、変異箇所)を特定する方法。異質倍数体の植物(キヌアは異質4倍体)でも検出が可能。本研究では、親から分離した後代について、野生型形質を示す個体群と、rebc変異形質を示す個体群を、それぞれまとめてゲノムを抽出し、次世代シークエンサーによって、それぞれの形質を示す個体群のシークエンスリードを獲得。その後、二形質間のシークエンスリードを比較することにより、形質を支配する遺伝子を特定した。
令和2年9月17日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2020/09/17-1.html磁性-プラズモンハイブリッドナノ粒子を用いて、従来分離が難しかった細胞小器官(オートファゴソームなど)の新たな分離法の開発に成功

磁性-プラズモンハイブリッドナノ粒子を用いて、従来分離が難しかった
細胞小器官(オートファゴソームなど)の新たな分離法の開発に成功
ポイント
- これまで分離が難しかった細胞小器官を磁気分離するためのプローブとして、粒径約15 nmで単分散なAg/FeCo/Agコア/シェル/シェル型磁性-プラズモンハイブリッドナノ粒子を創製した。
- ハイブリッドナノ粒子を哺乳動物細胞に取り込ませ、培養時間を変化させた際、ナノ粒子が細胞内のどの部分に局在するかということをAgコアのプラズモン散乱を利用して可視化することに成功した。
- 培養時間が30分~2時間の間でハイブリッドナノ粒子がオートファゴソームに局在することがわかったため、オートファゴソームをターゲットとして、適切な時間帯で細胞膜を破砕して磁気分離を行うことでオートファゴソームの分離に成功した。
- 単離したオートファゴソームをプロテオミクス/リピドミクス解析に供することで、オートファジーの機能欠損による疾患の創薬へと展開できる可能性がある。
- リガンド結合ハイブリッドナノ粒子を用いた汎用的かつ高選択的な細胞小器官分離技術へと拡張することで、基礎生物学上重要な発見を導く可能性があるほか、肥満や老化を防止する医療技術へと繋がることも期待される。
|
北陸先端科学技術大学院大学(学長・浅野哲夫、石川県能美市)、物質化学領域の前之園 信也 教授らは、東京大学、金沢大学ほかと共同で、独自開発の磁性-プラズモンハイブリッドナノ粒子を用いてオートファゴソームのイメージングと磁気分離に成功しました。この手法は、これまで分離が困難であった他の細胞小器官へ拡張可能なため、新たな細胞小器官分離法としての応用が期待されます。 2013年のノーベル生理学・医学賞は、「小胞輸送の分子レベルでの解析と制御メカニズムの解明」という功績に対して、米国の3名の研究者に贈られました。また、2016年のノーベル生理学・医学賞は、「オートファジー注1)の分子レベルでのメカニズムの解明」の功績に対して、東京工業大学・大隅 良典 栄誉教授に贈られたことはまだ記憶に新しいところです。これらの研究はいずれも"細胞内物質輸送"に関するものでした。細胞内物質輸送には多種多様な細胞小器官注2)が関与しており、それらの機能は細胞小器官に存在するタンパク質や脂質によって制御されています。従って、細胞小器官の機能を理解するためには、そこに存在するタンパク質/脂質を調べることが必要不可欠です。そのための有力な手段の一つとして、タンパク質/脂質が機能している小器官ごと単離して解析するという方法があります。細胞小器官の一般的な単離法には超遠心分離注3)がありますが、比重に差が無い異種の小器官の分離は困難であることに加え、分離工程が煩雑で手間がかかるほか、表在性タンパク質注4)の脱離や変性が問題となる場合もあるため、新たな分離法の開発が望まれています。 本成果は、アメリカ化学会が発行するオープンアクセスジャーナルであるACS Omega誌に2017年8月25日に掲載されました。 |
<今後の展開>
単離したオートファゴソームをプロテオミクス/リピドミクス解析に供することで、これまでとは異なる視点からオートファジーを俯瞰でき、オートファジーの機能欠損による疾患の創薬へと展開できる可能性があります。また、ハイブリッドナノ粒子表面に所望のリガンドを結合させることによって、目的の細胞小器官への受容体を介したターゲティングが可能なナノ粒子を作製し、そのリガンド結合ナノ粒子を用いて標的細胞小器官を高選択的に単離する技術を確立することで、基礎生物学上重要な発見を導く可能性があります。さらに、肥満や老化を防止する医療技術へと繋がることも期待されます。

図1 磁性-プラズモンハイブリッドナノ粒子を哺乳動物細胞にトランスフェクションした後、培養時間(図中右に行くに従って培養時間が長いことを意味する)とともにナノ粒子の局在が初期エンドソーム(early endosome)、オートファゴソーム(autophagosome)、オートファゴリソソーム(autophagolysosome)へと移行する様子をプラズモン散乱を利用した共焦点顕微鏡イメージングで確認でき、各々の時間帯で磁気分離を行うとそれぞれ異なる種類の細胞小器官を分離することが可能であることを示した図。
<論文>
| 掲載誌: | ACS Omega |
| 論文題目: | "Magnetic Separation of Autophagosomes from Mammalian Cells using Magnetic-Plasmonic Hybrid Nanobeads"(磁性-プラズモンハイブリッドナノ粒子を用いた哺乳動物細胞からのオートファゴソームの磁気分離) |
| 著者: | Mari Takahashi,1 Priyank Mohan,1 Kojiro Mukai,2 Yuichi Takeda,3 Takeo Matsumoto,4 Kazuaki Matsumura,1 Masahiro Takakura,5 Hiroyuki Arai,2 Tomohiko Taguchi,6 Shinya Maenosono1* 1北陸先端科学技術大学院大学 2東京大学大学院薬学系研究科 衛生化学教室 3大阪大学大学院医学系研究科 4金沢大学医薬保健研究域医学系 5金沢医科大学産科婦人科 6東京大学大学院薬学系研究科 疾患細胞生物学教室 |
| DOI: | 10.1021/acsomega.7b00929 |
| 掲載日: | 2017年8月25日 |
<用語解説>
注1)オートファジー
オートファジー(Autophagy)は、細胞が持っている、細胞内のタンパク質を分解するための仕組みの一つ。自食とも呼ばれる。酵母からヒトにいたるまでの真核生物に見られる機構であり、細胞内での異常なタンパク質の蓄積を防いだり、過剰にタンパク質合成したときや栄養環境が悪化したときにタンパク質のリサイクルを行ったり、細胞質内に侵入した病原微生物を排除することで生体の恒常性維持に関与している。
注2)細胞小器官
細胞の内部で特に分化した形態や機能を持つ構造の総称。細胞内器官やオルガネラとも呼ばれる。細胞小器官が高度に発達していることが、真核細胞を原核細胞から区別している特徴の一つである。
注3)超遠心分離
数万G(重力加速度)以上の遠心力をかける遠心分離法。
注4)表在性タンパク質
疎水性相互作用、静電相互作用など共有結合以外の力によって脂質二重層または内在性膜タンパク質と一時的に結合しているタンパク質。
注5)超常磁性
強磁性体やフェリ磁性体のナノ粒子に現れる。磁性ナノ粒子では磁化の向きが温度の影響でランダムに反転しうる。この反転が起こるまでの時間をネール緩和時間という。外場の無い状態で、磁性ナノ粒子の磁化測定時間がネール緩和時間よりもずっと長い時、磁化は平均してゼロであるように見える。この状態を超常磁性という。
注6)エンドサイトーシス
細胞が細胞外の物質を取り込む過程の一つ。細胞に必要な物質のあるものは極性を持ちかつ大きな分子であるため、疎水性の物質から成る細胞膜を通り抜ける事ができない、このためエンドサイトーシスにより細胞内に輸送される。
注7)オートファゴソーム
オートファジーの過程で形成される二重膜構造を有した袋状の細胞小器官。他の細胞小器官やタンパク質などを囲い込んだ後、リソソームと融合することで内容物を消化する。
注8)プラズモン
プラズマ振動の量子であり、金属中の自由電子が集団的に振動して擬似的な粒子として振る舞っている状態をいう。金属ナノ粒子ではプラズモンが表面に局在することになるので、局在表面プラズモンとも呼ばれる。
注9)トランスフェクション
人為的にDNAやウイルスなどを細胞に取り込ませる手法。
注10)プラズモン散乱イメージング
局在表面プラズモン共鳴に起因した光散乱を利用したイメージング。共焦点顕微鏡を用いたバイオイメージングでは一般的に蛍光色素が用いられるが、長時間観察では光退色が問題となる。しかし、プラズモン散乱を用いたイメージングでは光退色の心配がない。
注11)蛍光免疫染色
抗体に蛍光色素を標識しておき、抗原抗体反応の後で励起光を照射して蛍光発光させ、共焦点顕微鏡などで観察することによって本来不可視である抗原抗体反応(免疫反応)を可視化するための組織化学的手法。
注12)初期エンドソーム
初期エンドソームは、エンドサイトーシスされた物質を選別する場として機能する細胞小器官である。エンドサイトーシスによって細胞内へと取り込まれた物質は、まず細胞辺縁部に存在する初期エンドソームへと輸送される。初期エンドソームを起点として、分解される物質は分解経路へと、細胞膜で再利用される物質はリサイクリング経路へと選別されていく。
注13)オートファゴリソソーム
オートファゴソームとリソソームの融合によってできる細胞小器官。
注14)ウェスタンブロッティング
電気泳動によって分離したタンパク質を膜に転写し、任意のタンパク質に対する抗体でそのタンパク質の存在を検出する手法。
注15)LC3-II
LC3はオートファゴソームマーカーとして広く知られている。オートファジーが開始されると、LC3はプロペプチドとして発現し、直ちにC末端が切断されて細胞質型のLC3-Ⅰとなる。LC3-ⅠのC末端にホスファチジルエタノールアミンが付加され、膜結合型のLC3- IIへ変換する。LC3- IIはオートファゴソーム膜へと取り込まれて安定に結合するため、哺乳動物におけるオートファゴソーム膜のマーカーとして用いられている。
平成29年8月25日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2017/08/25-1.html



